Problema nº 3 de electrólisis. Primera ley de Faraday, tiempo para que la masa de un elemento se deposite en un electrodo - TP07
Enunciado del ejercicio nº 3
¿Cuántas horas demanda fabricar 45,36 kg de cloro electrolítico en una celda de NaCl por la que circulan 1.000 A? El rendimiento anódico para la reacción del cloro es del 85 %.
Desarrollo
Datos:
m = 45,36 kg
i = 1.000 A
ζCl = 0,000367 g/C *
Fórmulas:
m = ζ·i·t
Solución
Aplicamos la primera ley de Faraday para el oro trivalente:
m = ζ·i·t
Despejamos t:
![]()
Convertimos las unidades:
![]()
m = 45.360 g
Reemplazamos por los valores dados y resolvemos:
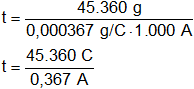
t = 123.596,7302 s
Este tiempo es para un rendimiento del 100 %. Para el rendimiento indicado demandará más tiempo, lo calculamos:
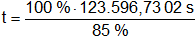
t = 145.407,9179 s
Pide el resultado en horas, adecuamos las unidades:
![]()
t = 40,39108832 h
Respuesta, el tiempo necesario para fabricar 45,36 kg de cloro electrolítico es:
t = 40,39 h
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP07
- | Siguiente ›
Ejemplo, cómo calcular el tiempo que demora la masa de un elemento en depositarse en un electrodo