Problema nº 4 de electrólisis. Primera ley de Faraday, masa depositada en un electrodo - TP07
Enunciado del ejercicio nº 4
Se hace circular una determinada cantidad de electricidad por dos celdas electrolíticas separadas, que contienen disolución de AgNO₃ y SnCl₂, respectivamente. Si en una de las celdas se depositan 2,0 g de plata, ¿cuántos gramos de estaño se depositarán en la otra celda?.
Desarrollo
Datos:
mAg = 2,0 g
EqAg⁺ = 107,87 g
EqSn²⁺ = 59,345 g
Fórmulas:
![]()
Solución
Aplicamos la segunda ley de Faraday.
Hallamos la masa del ion estañoso:
![]()
Despejamos mSn²⁺:
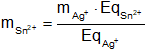
Reemplazamos por los datos y calculamos:
![]()
mSn²⁺ = 1,100305924 g
• Respuesta: mSn²⁺ = 1,1 g
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP07
- | Siguiente ›
Ejemplo, cómo calcular la masa de un elemento que se deposita en el electrodo