Problema nº 7 de electrólisis. Primera ley de Faraday, corriente requerida - TP07
Enunciado del ejercicio nº 7
El peróxido de hidrógeno puede obtenerse por las reacciones sucesivas:
![]()
La primera reacción es una reacción electrolítica y la segunda una destilación de vapor de agua. ¿Qué corriente tendría que utilizarse en la primera reacción de modo que se obtenga suficiente producto intermedio para producir 100 g de peróxido de hidrógeno puro por hora? Supóngase un rendimiento del 50 %.
Desarrollo
Datos:
m = 100 g
t = 1 h
η = 0,5
ζH⁺ = 0,000010 g/C *
Fórmulas:
m = ζ·i·t
Solución
La ecuación estequiométrica balanceada de la primera ecuación es la siguiente:
2·NH₄HSO₄ ⟶ H₂ + (NH₄)₂S₂O₈
Calculamos el mol de cada compuesto que interviene en la reacción:
2·NH₄HSO₄: 2·(14,0067 g + 5·1,00797 g + 32,064 g + 4·15,9994) = 230,2163 g
H₂: 2·1,00797 g = 2,01594 g
(NH₄)₂S₂O₈: 2·(14,0067 g + 4·1,00797 g) + 2·32,064 + 8·15,9994 = 228,20036 g
![]()
La ecuación estequiométrica balanceada de la segunda ecuación es la siguiente:
(NH₄)₂S₂O₈ + 2·H₂O ⟶ 2·NH₄HSO₄ + H₂O₂
Calculamos el mol de cada compuesto que interviene en la reacción:
(NH₄)₂S₂O₈: 2·(14,0067 g + 4·1,00797 g) + 2·32,064 + 8·15,9994 = 228,20036 g
2·H₂O: 2·(2·1,00797 g + 15,9994 g) = 36,03068 g
2·NH₄HSO₄: 2·(14,0067 g + 5·1,00797 g + 32,064 g + 4·15,9994) = 230,2163 g
H₂O₂: 2·1,00797 g + 2·15,9994 g) = 34,01474 g
![]()
Con las ecuaciones balanceadas y con los datos de las masas que intervienen de cada sustancia, planteamos:
Para obtener 34,01474 g de H₂O₂ se necesitan 228,20036 g de producto intermedio [(NH₄)₂S₂O₈] o, lo que es equivalente, 2,01594 g de H₂ que se desprenderán en el cátodo.
Realizamos los cálculos para 100 g de H₂O₂:
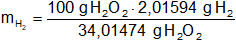
mH₂ = 5,92666591 g de H₂
Dado que el rendimiento del proceso es del 50 %, realizamos la corrección:
mH₂f = mH₂÷η
mH₂f = 5,92666591 g de H₂÷0,5
mH₂f = 11,85333182 g
Con estos datos aplicamos la primera ley de Faraday para el hidrógeno:
m = ζ·i·t
Despejamos i:
![]()
Convertimos las unidades de tiempo:
![]()
t = 3.600 s
Reemplazamos por los valores dados y resolvemos:
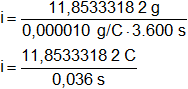
i = 329,2592172 A
Respuesta, la corriente requerida en la primera reacción es:
i = 329 A
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP07
- | Siguiente ›
Ejemplo, cómo calcular la corriente necesaria para que un elemento se deposite en el electrodo