Equilibrio químico: reacciones reversibles e irreversibles
Estudiemos una reacción genérica como la siguiente:
A + B ⟶ C + D (9)
A medida que la reacción progresa, disminuye el número de moléculas A y B, y aumenta el número de moléculas C y D. Como las sustancias C y D, no reaccionan entre sí, la reacción contínua hasta que las moléculas A y B se consumen. Este tipo de reacción se denomina irreversible. Graficando este caso tenemos:
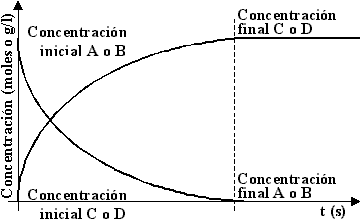
Gráfico de la concentración en función del tiempo de una reacción irreversible
Los procesos irreversibles son procesos que avanzan en una sola dirección
Por ejemplo, la acción del ácido clorhídrico sobre el cinc:
2·HCl + Zn ⟶ ZnCl₂ + H₂ (g)
Si en cambio la moléculas C y D pueden reaccionar entre sí, la reacción avanzará hacia la derecha mientras la concentración de las moléculas A y B sea importante, a medida que comiencen a formarse moléculas C y D, la velocidad de reacción disminuirá hasta que la concentración de las moléculas C y D sea tal que la reacción comenzará a desplazarse hacia la izquierda, hasta que se establezca un punto de equilibrio, donde ambas velocidades se equilibran, y en el cual coexistirán moléculas A, B, C y D. Este tipo de reacciones se denominan reversibles, y se representan con flecha de ida y vuelta:
A + B ⇌ C + D (10)
El siguiente gráfico representa una reacción reversible:
Un ejemplo de este caso es el siguiente:
CH₃—COOH + CH₃OH ⇌ CH₃—CO—O—CH₃ + H₂O
ácido etanoico + metanol ⇌ etanoato de metilo + agua.
Cabe aclarar que el concepto de reacción reversible o irreversible no es absoluto.
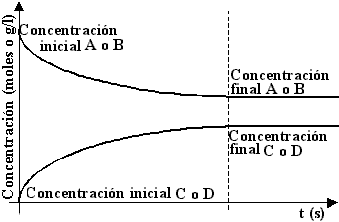
Gráfico de la concentración en función del tiempo de una reacción reversible
Hay reacciones reversibles que, según como se realicen, pueden convertirse en irreversibles, por ejemplo, si calentamos carbonato de calcio (CaCO₃) en un recipiente cerrado, en un principio, la reacción se desplazará hacia la derecha, produciendo dióxido de carbono y cal (CaO), pero cuando la presión aumente por formación de CO₂, la velocidad de reacción hacia la derecha, comenzará a disminuir e irá aumentando la velocidad hacia la izquierda, hasta que quede en equilibrio (reversible).
CaCO₃ ⇌ CO₂ + CaO
En cambio, si se procede en un recipiente abierto, el dióxido de carbono producido, se escapará a la atmósfera, sin dar lugar a la reacción inversa, y continuará hasta la total descomposición del carbonato de calcio (irreversible).
CaCO₃ ⟶ CO₂ (g) + CaO
Este es un ejemplo de una reacción reversible o incompleta que, por eliminación de uno de los productos de la reacción, se transforma en irreversible o completa.
La ley de acción de las masas, también se aplica a los sistemas reversibles o en equilibrio. Aplicando la ley a la reacción (10), primero a la que se desplaza a la derecha, tenemos:
v = [A]·[B] (11)
Y reemplazando v por kd, que es la constante de la velocidad hacia la derecha:
kd = [A]·[B] (12)
Luego, para la reacción hacia la izquierda:
v = [C]·[D]
kᵢ = [C]·[D] (13)
Dividiendo (13) por (12):
| k = | kᵢ | = | [C]·[D] | (14) |
| kd | [A]·[B] |
Donde "k" es la constante de equilibrio.
Principio de Le Châtelier
Si sobre un sistema en equilibrio, una acción exterior produce una modificación, el sistema reacciona en forma tal de contrarrestar u oponerse a esa modificación
Analicemos este principio con la reacción (10):
A + B ⇌ C + D (10)
1) Los efectos de la concentración: el aumento de las concentraciones de A y B, produce más C y D para contrarrestar el aumento de A y B. Ocurre lo mismo en el caso inverso
2) Los efectos de la presión: en el caso de que A o B sean gases, el aumento de presión, el sistema reaccionará disminuyendo su volumen para contrarrestar el aumento de presión, con lo cual la reacción se desplazará hacia la derecha
3) Los efectos de la temperatura: si la reacción entre A y B libera calor (exotérmica), y retiramos las calorías producidas, el sistema reaccionará produciendo más calor para contrarrestar la pérdida, con lo cual la reacción se desplazará hacia la derecha. Si por el contrario, le entregamos calorías, el sistema contrarrestará la modificación desplazándose hacia la izquierda
El aumento de temperatura retarda los procesos exotérmicos y acelera los endotérmicos.
Ante una reacción reversible (reacción 10), para lograr el máximo rendimiento, es decir que la reacción se desplace lo todo posible hacia la derecha, tenemos las siguientes opciones:
1) Aumentar la concentración de uno de los reactivos, por ejemplo, duplicando A, para contrarrestar este exceso, aumentaran las concentraciones de C y D, desplazando la reacción hacia la derecha.
2·A + B ⟶ C + D
2) Disminuir la concentración de uno de los productos de reacción, por ejemplo, retirando la mitad de C, para contrarrestar este exceso, disminuirán las concentraciones de A y B, desplazando la reacción hacia la derecha, esto se logra retirando C a medida se produce.
A + B ⟶ C + 0,5·D
3) Si A y/o B son gases, aumentando la presión (en un recipiente cerrado), logramos desplazar la reacción hacia la derecha.
A(g) + B(g) ⟶ C + D
4) Si C y/o D son gases, disminuyendo la presión (en un recipiente cerrado), logramos desplazar la reacción hacia la derecha.
A + B ⟶ C(g) + D(g)
5) Si la reacción entre A y B es exotérmica, una vez alcanzada la energía de activación, conviene refrigerar el sistema para favorecer la producción de C y D.
A + B ⟶ C + D + cal
6) Si la reacción entre A y B es endotérmica, se deberá entregar calor para alcanzar la energía de activación, y continuar calentando para favorecer la producción de C y D.
A + B ⟶ C + D - cal
Ejemplo: para la reacción reversible (10), en un recipiente cerrado de 10 litros de capacidad, la constante de equilibrio es k = 0,4; una vez alcanzado el punto de equilibrio, se detectaron las siguientes cantidades: 1,581 moles de A, 1,581 moles de B, 1 moles de C y 1 moles de D. ¿Cómo se puede modificar el sistema para alcanzar un rendimiento de 0,95?
Solución: el rendimiento es:
R = masa obtenida real/masa obtenida teórica.
Teóricamente:
1·A + 1·B ⇌ 1·C + 1·D
6 g + 4 g = 5 g + 5 g
10 g = 10 g
Donde R = 10 g/10 g = 1
En nuestro caso:
1,581 mol·A + 1,581 mol·B + 1 mol·C + 1 mol·D
9,487 g + 6,325 g + 5 g + 5 g
15,812 g + 10 g
Donde R₁ = 15,812 g/10 g = 0,63
Autor: Ricardo Santiago Netto. Argentina