Problema nº 2, constante de equilibrio químico, moles (ejercicio modelo) - TP01
Enunciado del ejercicio nº 2
Para la reacción:
H₂ + I₂ ⇌ 2·HI
La constante K = 62,5.
Al alcanzar el equilibrio, se han hallado 0,4 moles de yodo y 3 moles de yoduro de hidrógeno, en un volumen total de 25 l. ¿Cuántos moles de hidrógeno hay en el sistema?
Desarrollo
Datos:
K = 62,5
Moles I = 0,4
Moles HI = 3
V = 25 l
Solución
La ecuación equilibrada dada:
H₂ + I₂ ⇌ 2·HI
Calculamos la concentración de cada compuesto en 25 l. Para el yodo:
![]()
Para el yoduro de hidrógeno:
![]()
Para el hidrógeno:
![]()
En el equilibrio:
![]()
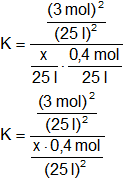
Simplificamos los denominadores:
![]()
Despejamos la concentración del hidrógeno x:
![]()
Reemplazamos por los datos y calculamos:
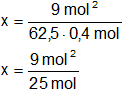
x = 0,36 moles
Respuesta: la cantidad de moles de hidrógeno que hay en el sistema es 0,36
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP01
- | Siguiente ›
Ejemplo, cómo calcular los moles dada la constante de equilibrio