Problema nº 1, constante de equilibrio químico - TP03
Enunciado del ejercicio nº 1
Problema nº 1
Se calienta una cantidad determinada de PCl₅ en un recipiente de 15 litros a 300 °C. En el equilibrio, el recipiente contiene: 0,25 moles/l de PCl₅, 0,35 moles/l de PCl₃ y 0,35 moles/l de Cl₂.
Calcular la constante de equilibrio K para la disociación de PCl₅ en las condiciones dadas.
Desarrollo
Datos:
Moles PCl₅ = 0,25
Moles PCl₃ = 0,35
Moles Cl₂ = 0,35
V = 15 l
Solución
La ecuación equilibrada dada:
PCl₅(g) ⟶ PCl₃(g) + Cl₂(g)
Calculamos la concentración de cada compuesto en 15 l.
Para el [PCl₅]:
![]()
Para el [PCl₃]:
![]()
Para el [Cl₂]:
![]()
En el equilibrio:
![]()
Reemplazamos:
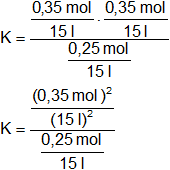
Simplificamos los denominadores y las unidades:
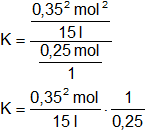
Calculamos:
![]()
K = 0,032666667 moles/l
Respuesta: la constante de equilibrio K para la disociación de PCl₅ es 0,033
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP03
- | Siguiente ›
Ejemplo, cómo calcular la constante de equilibrio