Problema nº 8 de equilibrio químico, moles - TP03
Enunciado del ejercicio nº 8
Se tiene:
PCl₅(g) ⟶ PCl₃(g) + Cl₂(g)
Calcular el número de moles de Cl₂ producidos en el equilibrio cuando se calienta un mol de PCl₅ a 250 °C en un recipiente de 5 litros. La constante de equilibrio a 250 °C es 0,041 moles/l para esta disociación.
Solución
Expresamos la ecuación equilibrada de la reacción:
![]()
Planteamos los moles iniciales y en el equilibrio:
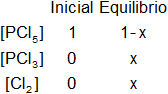
x será el número de moles de PCl₃ y Cl₂ en el equilibrio.
En el equilibrio desaparecen x moles de PCl₅ para formar x moles de PCl₃ y Cl₂.
Aplicamos la fórmula de la constante de equilibrio:
![]()
Reemplazamos por los datos y calculamos:
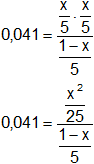
Simplificamos los denominadores:
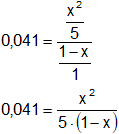
0,041·5·(1 - x) = x²
Aplicamos distributiva del producto con respecto a la resta:
0,205 - 0,205·x = x²
Igualamos a cero:
x² + 0,205·x - 0,205 = 0
Aplicamos la ecuación de Báscara o Bhaskara:
![]()
Siendo:
a = 1
b = 0,205
c = -0,205
Reemplazamos y resolvemos, obtendremos dos valores:
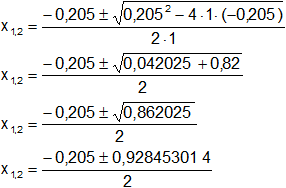
Calculamos los valores de x1,2 por separado según el signo del resultado de la raíz:
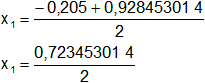
x₁ = 0,361726507
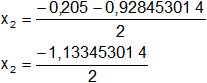
x₂ = -0,566726507 (se descarta por ser < 0)
Respuesta: la cantidad de moles de Cl₂ que hay en el equilibrio es 0,36.
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP03
- | Siguiente ›
Ejemplo, cómo calcular los moles en el equilibrio