Problema nº 1 de equilibrio químico, presiones parciales, moles y presiones parciales de una mezcla de gases - TP04
Enunciado del ejercicio nº 1
A 817 °C, la constante Kₚ para la reacción entre CO₂ puro y grafito caliente en exceso es de 10 atm. Se pide:
a) ¿Cuál es el análisis de los gases en el equilibrio a 817 °C y una presión total de 4 atm?
b) ¿Cuál es la presión parcial del CO₂ en el equilibrio?
c) ¿Para qué presión parcial dará el análisis de los gases 6 % de CO₂ en volumen?
Solución
Expresamos la ecuación equilibrada de la reacción:
![]()
a)
Para esta reacción tomamos un mol de CO₂, ya que no especifica la cantidad.
Planteamos los moles iniciales y en el equilibrio, y el gas total:

Como la concentración efectiva de todos los sólidos es una constante, el grafito no se incluye en la constante de equilibrio, mientras que esté presente en exceso.
Aplicamos la fórmula de la constante de equilibrio de presiones parciales:
![]()
O, lo que es igual:
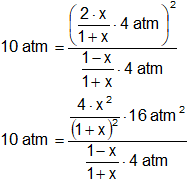
Simplificamos:
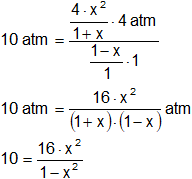
Despejamos x:
10·(1 - x²) = 16·x²
10 - 10·x² = 16·x²
16·x² + 10·x² = 10
26·x² = 10
![]()
x = 0,620173673
Por tanto, en el equilibrio:
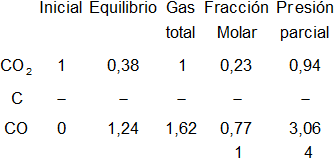
b)
De la tabla anterior:
pCO₂ = 0,94 atm
Respuesta b): la presión parcial del CO₂ en el equilibrio es:
pCO₂ = 0,94 atm
c)
[CO₂] = 6 % v/v
Luego:
[CO] = 100 % - 6 %
[CO] = 94 % v/v
Por tanto:
pCO = 0,94·p
pCO₂ = 0,06·p
Aplicamos la fórmula de la constante de equilibrio de presiones parciales:
![]()
Reemplazamos por los datos y calculamos:
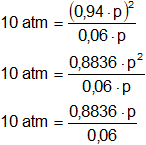
10 atm·0,06 = 0,8836·p
0,6 atm = 0,8836·p
Despejamos p:
![]()
p = 0,67904029 atm
Respuesta c): la presión parcial para la cual el análisis de los gases dará 6 % de CO₂ en volumen es:
p = 0,68 atm
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP04
- | Siguiente ›
Ejemplo, cómo calcular los moles y las presiones parciales de una mezcla de gases en el equilibrio