Problema nº 2 de equilibrio químico, principio de Le Châtelier, variación de la presión y la temperatura - TP04
Enunciado del ejercicio nº 2
Predecir el efecto de un aumento de temperatura y un aumento de la presión, por separado, en las siguientes reacciones en el equilibrio:
a) H₂O(g) ⇌ H₂(g) + ½·O₂(g)
b) 2·O₃(g) ⇌ 3·O₂(g)
c) CO(g) + 2·H₂(g) ⇌ CH₃OH(g)
Solución
a)
1- Aumento de temperatura.
H₂O(g) ⇌ H₂(g) + ½·O₂(g)
Buscamos los datos en la tabla de entalpías de formación y calculamos la entalpía:
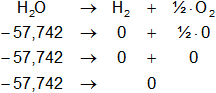
Planteamos la ecuación:
ΔH = Hₚ - Hᵣ
Reemplazamos por los datos y calculamos:
ΔH = 0 kcal/mol - (-57,742 kcal/mol)
ΔH = 57,742 kcal/mol
La reacción original quedaría:
H₂O(g) ⇌ H₂(g) + ½·O₂(g) - 57,742 kcal
La reacción es endotérmica.
Según el principio de Le Châtelier, un aumento de la temperatura favorece el proceso endotérmico.
Respuesta a-1): la reacción se desplaza hacia la derecha.
2- Aumento de la presión.
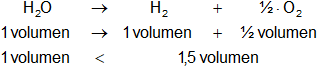
En la reacción intervienen más volúmenes de productos que de reactantes.
Respuesta a-2): la reacción se desplaza hacia la izquierda.
b)
1- Aumento de temperatura.
2·O₃(g) ⇌ 3·O₂(g)
Buscamos los datos en la tabla de entalpías de formación y calculamos la entalpía:
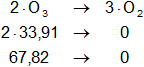
Planteamos la ecuación:
ΔH = Hₚ - Hᵣ
Reemplazamos por los datos y calculamos:
ΔH = 0 kcal/mol - 67,82 kcal/mol
ΔH = -67,82 kcal/mol
La reacción original quedaría:
2·O₃(g) ⇌ 3·O₂(g) + 67,82 kcal
La reacción es exotérmica, desprende calor.
Según el principio de Le Châtelier, si se aumenta la temperatura el sistema reaccionará al cambio desprendiendo menos calor.
Respuesta b-1): la reacción se desplaza hacia la izquierda.
2- Aumento de la presión.
![]()
En la reacción intervienen más volúmenes de productos que de reactantes.
Respuesta b-2): la reacción se desplaza hacia la izquierda.
c)
1- Aumento de temperatura.
CO(g) + 2·H₂(g) ⇌ CH₃OH(g)
Buscamos los datos en la tabla de entalpías de formación y calculamos la entalpía:
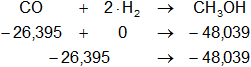
Planteamos la ecuación:
ΔH = Hₚ - Hᵣ
Reemplazamos por los datos y calculamos:
ΔH = -48,039 kcal/mol - (-26,395 kcal/mol)
ΔH = -48,039 kcal/mol + 26,395 kcal/mol
ΔH = -21,644 kcal/mol
La reacción original quedaría:
CO(g) + 2·H₂(g) ⇌ CH₃OH(g) + 21,644 kcal
La reacción es exotérmica.
Según el principio de Le Châtelier, un aumento de la temperatura retarda los procesos exotérmicos.
Respuesta c-1): la reacción se desplaza hacia la izquierda.
2- Aumento de la presión.
Es una reacción de formación, todas las sustancias son gaseosas.
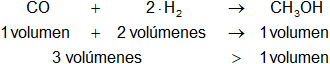
En la reacción intervienen más volúmenes de reactantes que de productos.
Según el principio de Le Châtelier, con el aumento de presión se produce más metanol. La reacción se desplaza hacia la derecha.
Respuesta c-2): la reacción se desplaza hacia la derecha.
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP04
- | Siguiente ›
Ejemplo, cómo se comporta una reacción con la variación de la temperatura y de la presión