Problema nº 2 de estequiometria de las reacciones químicas, reactivos y productos - TP06
Enunciado del ejercicio nº 2
La soda cáustica (NaOH) se prepara comercialmente mediante la reacción del carbonato de sodio (Na₂CO₃) con cal apagada (Ca(OH)₂). ¿Qué masa de hidróxido de sodio puede obtenerse tratando 1 kg de carbonato de sodio con hidróxido de calcio?
Desarrollo
Datos:
mNa₂CO₃ = 1 kg = 1.000 g
Solución
La ecuación estequiométrica balanceada es la siguiente:
Na₂CO₃ + Ca(OH)₂ ⟶ NaOH + CaCO₃
Calculamos el mol de cada compuesto que interviene en la reacción:
Na₂CO₃: 2·22,9898 g + 12,01115 g + 3·15,9994 g = 105,98895 g
Ca(OH)₂: 40,08 g + 2·(15,9994 g + 1,00797 g) = 74,09474 g
NaOH: 22,9898 g + 15,9994 g + 1,00797 g = 39,99717 g
CaCO₃: 40,08 g + 12,01115 g + 3·15,9994 g = 100,08935 g
Calculamos las masas de los moles que intervienen en la reacción balanceada, la suma de las masas de ambos miembros debe ser igual:
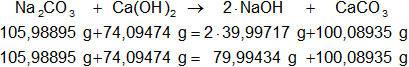
Calculamos la masa de hidróxido de sodio necesaria:
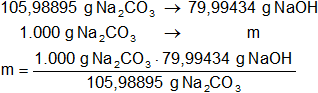
x = 754,7422632 g de NaOH
Resultado: la masa de hidróxido de sodio que se puede obtener es 755 g.
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP06
- | Siguiente ›
Ejemplo, cómo calcular las masas de las sustancias reaccionantes y de los productos de reacción