Problema nº 4 de estequiometria de las reacciones químicas, reactivos y productos - TP06
Enunciado del ejercicio nº 4
El ácido clorhídrico comercial se prepara normalmente calentando cloruro de sodio con ácido sulfúrico concentrado. ¿Qué masa de ácido sulfúrico al 90 % en peso de concentración se necesita para obtener 453,6 kg de ácido clorhídrico concentrado al 42 % en peso?
Desarrollo
Datos:
mHCl = 453,6 kg = 453.600 g (42 %)
Solución
La ecuación estequiométrica balanceada es la siguiente:
H₂SO₄ + 2·NaCl ⟶ 2·HCl + Na₂SO₄
Calculamos el mol de cada compuesto que interviene en la reacción:
H₂SO₄: 2·1,00797 g + 12,01115 g + 4·15,9994 g = 98,07754 g
NaCl: 40,08 g + 35,453 g = 58,4428 g
HCl: 1,00797 g + 35,453 g = 36,46097 g
Na₂SO₄: 2·40,08 g + 12,01115 g + 4·15,9994 g = 142,0412 g
Calculamos las masas de los moles que intervienen en la reacción balanceada, la suma de las masas de ambos miembros debe ser igual:
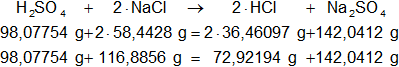
Calculamos la masa de ácido sulfúrico al 90 %:
mH₂SO₄ = 0,9·98,07754 g
mH₂SO₄ = 108,9750444 g
La cantidad de ácido clorhídrico requerido tiene una concentración del 42 %, calculamos la cantidad de ácido clorhídrico puro:
mHCl = 0,42·453.600 g
mHCl = 284.702,432 g
Luego hallamos la masa de ácido sulfúrico al 90 % para obtener HCl:
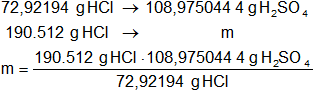
x = 284.702,432 g de H₂SO₄ (90 %)
Resultado: la masa de ácido sulfúrico requerida es 284,7 kg.
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP06
- | Siguiente ›
Ejemplo, cómo calcular las masas de las sustancias reaccionantes y de los productos de reacción