Estructura atómica: modelos atómicos
Modelo científico
Supongamos que nos dan una caja cerrada que no nos está permitido abrir y que contiene algo en su interior. Como no la podemos abrir, tendremos que recurrir a hacer una serie de pruebas o ensayos para averiguar lo que contiene: agitarla, pesarla. Con los datos obtenidos podremos forjar una idea, una imagen mental, sobre el contenido de la caja. Por otra parte, la idea o modelo que imaginamos nos permitirá formular predicciones: si, por ejemplo, concluimos que se trata de un líquido, podremos predecir que al hacerle un agujero, tal líquido se derramará.
Una idea o teoría sobre la naturaleza de un fenómeno para explicar hechos experimentales constituye lo que en ciencias se denomina modelo científico.
Un ejemplo de modelo científico es el modelo atómico. Nadie ha visto nunca un átomo. Es más, la propia ciencia predice que nunca se podrá ver. Sin embargo, observando una serie de fenómenos en el comportamiento de la materia es posible desarrollar una serie de ideas de como será la estructura de la materia.
Evolución de los modelos atómicos
Demócrito, filosofo griego, fueron probablemente los primeros en creer que la materia estaba constituida por partículas que denominaron átomos, palabra que significa "sin división", ya que consideraban el átomo como único e indivisible. Se basaba, no en pruebas experimentales, sino en un razonamiento que puede sintetizarse así: un trozo de metal puede cortarse en 2 pedazos y cada uno de éstos en dos pedazos más …; estos pueden dividirse sucesivamente hasta llegar a un momento en que se obtenga una partícula que ya no sea posible dividirla: el átomo. Pensaba que los átomos tendrían formas y tamaños distintos: esféricos, cilíndricos, irregulares …
Empédocles, otro filósofo griego, no creía en tal teoría y postulaba la idea de que la materia estaba constituida por 4 elementos que se combinaban entre sí. Según él, la vida sólo era posible donde había humedad: una flor sin agua se muere; luego el primer elemento era el agua. Pero el agua no es sólida, se escapa de las manos. Una montaña no puede estar formada de agua y necesita, por tanto, otro elemento que le dé consistencia, solidez. La tierra fue el segundo elemento de que habló Empédocles, pues, a su juicio, daba consistencia al agua. Sin embargo, el barro que resultaba de esta mezcla era muy blando. Creyó entonces que quien le daba dureza era un tercer elemento, el aire, pues seca o evapora el agua que contienen las cosas. Por último, Empédocles consideró el fuego como 4° elemento.
Posteriormente transcurre un largo período en la historia de la Química, la Alquimia, donde la preocupación primordial es tratar de convertir los metales conocidos en oro.
Hacia el 1.800, el profesor inglés John Dalton recogió la idea del átomo que dio el filosofo Demócrito, si bien esta vez basándose en métodos experimentales. Mediante el estudio de las leyes ponderales, concluye que:
La materia está constituida por partículas indivisibles (átomos), todos los átomos de un mismo elemento químico son iguales, los átomos de elementos diferentes son también diferentes.
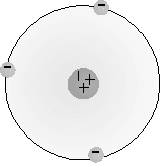
Modelo atómico de Thompson

En 1.897 Joseph John Thompson realiza una serie de experimentos y descubre el electrón. En tubos de gases a baja presión en los que se establece una diferencia de potencial superior a 10.000 volt, se comprobó que aparecían partículas con carga eléctrica negativa a las que se llamó electrones, y demostró que habían sido arrancados de los átomos (los cuales eran neutros). Tal descubrimiento modificó el modelo atómico de Dalton, que lo consideraba indivisible. Thompson supuso el átomo como una esfera homogénea e indivisible cargada positivamente en la que se encuentran incrustados los electrones.
Modelo atómico de Rutherford

Posteriormente otro físico inglés, Lord Ernest Rutherford of Nelson, realizó una serie de experimentos. Hizo incidir sobre una lámina finísima de oro un delgado haz de partículas cargadas positivamente de masa mucho mayor que el electrón y dotadas de energía cinética alta. En el choque observó distintos comportamientos:
- La mayoría atravesaban la lámina sin desviarse
- Algunas se desviaban
- Muy pocas retrocedían
Esta experiencia implicaba:
- Que los átomos estaban casi vacíos, pues la mayoría de las partículas las atravesaban
- Que hay una zona cargada positivamente, ya que algunas partículas retrocedían o se desviaban. Esta zona debe estar muy concentrada ya que es mayor el número de desviaciones que de choques
Esto le condujo a proponer en 1.911 un nuevo modelo atómico en el que se afirmaba que los átomos estaban constituidos por 2 zonas bien diferenciadas:
- Una de carga positiva con el 99,9% de la masa muy concentrada y por tanto de gran densidad a la que llamó núcleo
- Otra rodeando al núcleo a la que llamó corteza donde estaban los electrones con carga negativa girando alrededor del núcleo
Sin embargo, el modelo de Rutherford presentaba fallos:
- Según la teoría clásica de electromagnetismo, una partícula eléctrica acelerada emite energía. Y el electrón girando el torno al núcleo está sometido a una aceleración centrípeta por lo que irradiaría energía, perdería velocidad y, por fin, caería al núcleo desestabilizando el átomo. Pero como el átomo de hecho es estable, las cosas no pueden ocurrir según el modelo de Rutherford
- No explicaba los espectros
Radioactividad
Radioactividad es la propiedad que presentan los núcleos atómicos de ciertos isótopos de modificar espontáneamente su constitución, emitiendo simultáneamente una radiación característica.
La radioactividad puede ser:
- Radioactividad natural: Es la que manifiestan los isótopos que se encuentran en la naturaleza
- Radiactividad artificial o inducida: Es la que ha sido provocada por transformaciones nucleares artificiales
Radiactividad natural
Película fotográfica
En 1.896 Antoine Henri Becquerel descubrió que ciertas sales de uranio emitían radiaciones espontáneamente, al observar que velaban las placas fotográficas envueltas en papel negro.
Hizo ensayos con el mineral en caliente, en frío, pulverizado, disuelto en ácidos y la intensidad de la misteriosa radiación era siempre la misma. Por tanto, esta nueva propiedad de la materia, que recibió el nombre de radiactividad, no dependía de la forma física o química en la que se encontraban los átomos del cuerpo radiactivo, sino que era una propiedad que radicaba en el interior mismo del átomo.
El estudio del nuevo fenómeno y su desarrollo posterior se debe casi exclusivamente a los esposos Marie Curie y Pierre Curie, quienes encontraron otras sustancias radiactivas como el torio, polonio y radio. La intensidad de la radiación emitida era proporcional a la cantidad de uranio presente, por lo que dedujo Marie Curie que la radiactividad era una propiedad atómica.
El fenómeno de la radiactividad se origina exclusivamente en el núcleo de los átomos radiactivos. Y la causa que lo origina se cree que es debida a la interacción neutrón-protón del mismo.
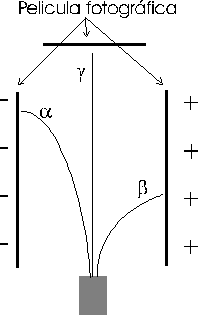
Al estudiar la radiación emitida por el radio se comprobó que era compleja, pues al aplicarle un campo magnético parte de ella se desviaba de su trayectoria y otra parte no.
Se comprobó que dicha radiación consta de 3 partes:
• Radiación α: Identificada con núcleos de helio (⁴₂He), constituidos por dos protones y dos neutrones. Por tanto, poseen dos cargas positivas y son desviadas por campos eléctricos y magnéticos. Es poco penetrante aunque muy ionizante
• Radiación β: Son electrones resultantes de la desintegración de los neutrones del núcleo:
Neutrón ⟶ protón + electrón + neutrino
Debido a su carga es desviada por campos eléctricos y magnéticos. Es más penetrante, aunque su poder de ionización no es tan elevado como el de la radiación α.
Radiación γ: No es corpuscular como las 2 anteriores, sino de naturaleza electromagnética. Al no tener carga, los campos eléctricos y magnéticos no la afectan. Es la más penetrante, y muy peligrosa.
Las leyes de desintegración radiactiva, descritas por Frederick Soddy y Kasimir Fajans, son:
- Cuando un átomo radiactivo emite una partícula α, la masa del átomo resultante disminuye en 4 unidades y el número atómico en 2
- Cuando un átomo radiactivo emite una partícula β, la masa del átomo resultante no varía y su número atómico aumenta en una unidad
- Cuando un núcleo excitado emite una radiación γ no varía ni su masa ni su número atómico, solo pierde una cantidad de energía hv
Las dos primeras leyes nos indican que cuando un átomo emite una radiación α o β se transforma en otro átomo de un elemento diferente. Este nuevo elemento puede ser radiactivo, transformándose en otro, y así sucesivamente, dando lugar a las llamadas series radiactivas.
Radiactividad artificial
Se produce la radiactividad inducida cuando se bombardean ciertos núcleos estables con partículas apropiadas.
Si la energía de estas partículas tiene un valor adecuado penetran dentro del núcleo bombardeado y forman un nuevo núcleo que, en caso de ser inestable, se desintegra después radiactivamente.
Fue descubierta por los esposos Marie Curie y Pierre Curie, bombardeando núcleos de boro y aluminio con partículas a. Observaron que las sustancias bombardeadas emitían radiaciones después de retirar el cuerpo radiactivo emisor de las partículas a de bombardeo.
El estudio de la radiactividad permitió un mayor conocimiento de la estructura del núcleo atómico y de las partículas subatómicas. Se abre la posibilidad de convertir unos elementos en otros. Incluso el sueño de los alquimistas de transformar otros elementos en oro se hace realidad, aunque no resulte rentable.
Autor: José González.
Editor: Ricardo Santiago Netto (Administrador de Fisicanet).
- ‹ Anterior
- |
- Siguiente ›