Propiedades de los fluidos
Difusión
Se llaman fenómenos de difusión a aquellos en que se produce la penetración de unas sustancias en otras.
Se trata de fenómenos de naturaleza molecular y los casos más corrientes son los de difusión de líquido en líquido, gas en gas, gas en líquido y gas o líquido en sólido. Se admite que en algunos casos ha llegado a producirse difusión de sólido en sólido (oro en plomo).
En algunos casos en que una pared porosa separa gases, se produce difusión de uno de ellos hacia la pared, que el gas atraviesa y sale hacia el otro lado de la pared; al salir de la pared en fenómeno se llama efusión.
Si la pared es tal que sólo la atraviesa un solo gas de una mezcla de gases o sólo el solvente de una solución, se llama semipermeable.
Es fácil observar fenómenos de difusión. Para gases basta tomar dos recipientes, uno con aire y otro con un gas más pesado y unir ambos recipientes por sus bocas. Aunque el gas más pesado se ubique mayormente en la parte más baja, al cabo de cierto tiempo se observará que en los dos recipientes hay una mezcla homogénea de ambos gases. Se ha producido la difusión de uno en el otro.
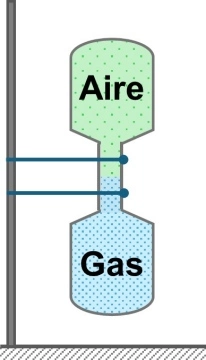
Esquema de difusión-efusión de gases
Para difusión en líquidos es necesario que sean líquidos miscibles y que no reaccionen químicamente. Si en un recipiente con agua se vierte con mucho cuidado un poco de alcohol coloreado como para que flote en la parte superior, se observará que la superficie de separación pierde nitidez y poco a poco el alcohol se difunde en toda la masa líquida.
Un método para estudiar los fenómenos de difusión consiste en colocar dentro de un recipiente con agua un frasco con el líquido cuya difusión se quiere estudiar. Se destapa por un dispositivo especial y después de un tiempo se determina la cantidad de sustancia que se ha difundido en el agua.
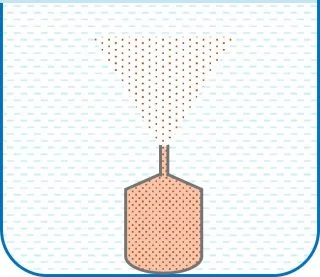
Esquema de difusión-efusión de líquidos
Estos fenómenos se explican por la teoría cinética de la materia; las moléculas de uno de los líquidos o gases que llegan a la superficie de separación chocan con las del otro y progresivamente se van penetrando mutuamente.
Llamamos concentración de un componente en un punto, a la relación entre la masa de ese componente y la masa total en un pequeño volumen rodeando a ese punto.
En general, observamos que cada gas o líquido se difunde hacia la zona en que disminuye su concentración.
Si medimos la cantidad q de sustancia que en el tiempo t atraviesa una superficie s entre dos puntos situados a la distancia l en los cuales las concentraciones son c₁ y c₂, tendremos:
![]()
k: coeficiente de difusión.
Se suele expresar midiendo el tiempo en días y la longitud en centímetros o bien en unidades C.G.S.
Para la difusión en agua de una solución saturada de sal de mar se ha encontrado el coeficiente:
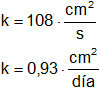
Efusión
Se produce cuando una pared porosa de yeso, magnesio u otra sustancia, separa dos gases diferentes. En ese caso se mezclan a través de la pared, pero la velocidad de pasaje es diferente para cada gas. La ley de Graham dice que la velocidad de pasaje es proporcional a la presión del gas e inversamente proporcional a la raíz cuadrada de su densidad.
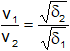
Donde:
v: es la velocidad de efusión.
δ: es la densidad del gas.
Esta ley concuerda con lo que se podría prever en base a la teoría cinética.
También se producen fenómenos de difusión de gases a través de paredes sólidas. Una lámina delgada de caucho es atravesada por el oxígeno con una velocidad 2,5 veces mayor que por el nitrógeno. Por eso, si se hace pasar aire por una membrana de caucho, su riqueza en oxígeno aumenta del 21 a 40 %.
La difusión de gases a través de líquidos puede observarse haciendo flotar en dióxido de carbono una pompa de jabón llena de aire. Aumenta de volumen hasta romperse por efecto del dióxido de carbono que la atraviesa.
Las paredes semipermeables, como hemos dicho, se caracterizan por dejar pasar un solo gas, deteniendo a todos los demás. El platino, el cuarzo y el paladio, calentados al rojo, dejan pasar al hidrógeno y detienen a los demás gases.
Difusión y efusión de gases
Si se añade una pequeña cantidad de un gas, A, en un extremo de un recipiente cerrado que contiene otro gas, B, el primero difundirá o se distribuirá él mismo uniformemente a través de todo el recipiente en un corto tiempo.
Los diferentes gases tienen sus propias velocidades de difusión. El experimento más sencillo para caracterizar la movilidad intrínseca de cualquier gas es un experimento de efusión en el que se permite que el gas escape a través de orificios pequeños en un espacio en que se ha hecho el vacío.
En un experimento de esta clase, las velocidades de efusión de los gases, medidas en función del número de moléculas o moles de gas que escapan por unidad de tiempo, son inversamente proporcionales a la raíz cuadrada de sus densidades (ley de Graham). Entonces:
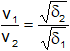
Donde:
v: es la velocidad de efusión.
δ: es la densidad del gas.
Como el peso molecular de un gas es proporcional a su densidad, la ecuación anterior puede escribirse:
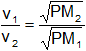
En donde PM es el peso molecular del gas.
Ejemplo:
Calcular las velocidades de efusión relativas del hidrógeno y oxígeno a través de un pequeño orificio. Emplear los siguientes pesos moleculares:
PMH2 = 2 g
PMO2 = 32 g
Solución:
Empleamos la fórmula de peso molecular.
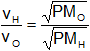
Reemplazamos por los datos y calculamos:
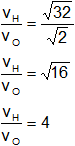
La velocidad de efusión relativa del hidrógeno respecto al oxígeno es 4:
vH2 = 4·vO2
Bibliografía:
"Física elemental". José S. Fernández y Ernesto E. Galloni. Argentina.
Jerome L. Rosenberg. "Teoría y problemas de química general". Libros McGraw-Hill de México S. A. de C. V. México.
Robert C. Smoot y Jack Price. "Química, Un curso moderno". Compañía Editorial Continental S. A., México.
Autor: Ricardo Santiago Netto. Argentina
¿Qué es difusión y efusión?