Osmosis
Los fenómenos osmóticos se producen por la difusión de líquidos a través de membranas semipermeables, que se caracterizan por dejar pasar unas sustancias e impedir el pasaje de otras.
En la naturaleza existen membranas semipermeables, como la envoltura del protoplasma de las células vegetales, el pergamino, etc.
Si tomamos una célula vegetal y la sumergimos en agua pura, como en su interior posee una solución con 7,5 de cloruro de sodio por litro, el agua penetra al interior y como la sal no sale, aumenta de volumen hasta romperse. Inversamente, colocada en una solución de sal de mayor concentración que la propia, disminuye el volumen, pues el agua sale hacia el exterior.
Se obtienen también membranas semipermeables artificiales. Las que dan mejor resultado son las obtenidas colocando en un vaso poroso una solución de ferrocianuro de potasio y sumergiéndolo en otra solución de sulfato de cobre. En el interior de los poros se forma un precipitado de ferrocianuro de cobre, que constituye una membrana semipermeable caracterizada por dejar pasar el agua y detener sustancias disueltas, como, por ejemplo, el azúcar.
La comprobación se realiza en las siguientes condiciones: se pega al vaso en que se ha formado la membrana semipermeable, un largo tubo de vidrio. Se lo llena hasta cierto nivel con una solución cualquiera, supongamos que sea de azúcar, y se sumerge en agua pura. Se observará que el nivel asciende en el tubo, pues el agua pasa a través de la membrana semipermeable, es decir, el disolvente que entre forzará a ascender por dicho tubo parte de la disolución. El peso de la misma en el tubo ejercerá una presión hacia abajo que tenderá a oponerse a la penetración de más disolvente a través de la membrana. Finalmente, ambas fuerzas se equilibrarán entre sí y no entrará más disolvente. Estas dos fuerzas son el peso de la columna de líquido en el tubo y la fuerza impulsora que tiende a igualar las concentraciones a ambos lados de la membrana.
La altura h mide el exceso de presión de la solución con respecto al solvente puro. La presión hidrostática en el punto de equilibrio se denomina presión osmótica de la solución.
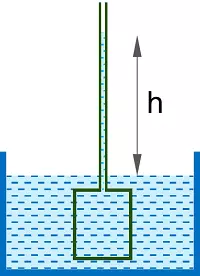
Presión osmótica
1- La presión osmótica de la solución es proporcional a la concentración.
2- Es proporcional a la temperatura.
Resulta, pues, una ley análoga a la de la presión de los gases ideales.
π·V = n·R·T (Ley de Van't Hoff)
Donde:
n: es el número de moles disueltos.
V: el volumen de la solución.
R: la constante de los gases.
Esta fórmula vale para las soluciones no electrolíticas, es decir, para las soluciones que no se descomponen por efecto de la corriente eléctrica.
Dos soluciones de igual presión osmótica se llaman isotónica.
El hecho de disolver una sustancia trae aparejadas modificaciones en la tensión de vapor y en los puntos de ebullición y de solidificación del solvente. Las leyes que rigen esas modificaciones y los nombres que recibe su estudio son los siguientes:
1° La tensión de vapor de la solución es menor que la del solvente puro a igual temperatura (tonometría).
2° El punto de ebullición de la solución es mayor que el del solvente puro a igual presión (ebulloscopía).
3° El punto de solidificación de la solución es menor que el del solvente puro (crioscopía).
Las leyes de Raoult establecen que dichas modificaciones son proporcionales al número de moles de sustancia disuelta en la unidad de volumen de solución.
En las soluciones isotónicas adquieren el mismo valor. Así, por ejemplo: una molécula gramo de azúcar disuelta en 10 litros de agua y una molécula gramo de urea también disuelta en 10 litros de agua, constituyen soluciones isotónicas. Ambas tienen igual presión osmótica y, además, igual tensión de vapor, por lo que hierven y se congelan a la misma temperatura.
Las medidas de los ascensos del punto de ebullición o los descensos de la tensión de vapor o el punto de solidificación, se aplican a la determinación d pesos moleculares.
Bibliografía:
"Física elemental". José S. Fernández y Ernesto E. Galloni. Argentina.
Jerome L. Rosenberg. "Teoría y problemas de química general". Libros McGraw-Hill de México S. A. de C. V. México.
Robert C. Smoot y Jack Price. "Química, Un curso moderno". Compañía Editorial Continental S. A., México.
Autor: Ricardo Santiago Netto. Argentina
¿Qué es osmosis?