Problema nº 10 de gases ideales, volumen de un gas - TP01
Enunciado del ejercicio nº 10
El mol de una sustancia en estado gaseoso es 40 g, si la densidad a 10 °C y 900 mm Hg es de 2 g/dm³, el volumen que ocupa esa sustancia es:
a) 44,8 dm³
b) 1 dm³
c) 22,4 dm³
d) 48 dm³
Desarrollo
Datos:
M = 40 g
T = 10 °C = 283 K
p = 900 mm Hg = 1,1842 atm
δ = 2 g/dm³
R = 0,08205 atm·dm³/K·mol
Fórmulas:
![]()
![]()
Solución
Aplicamos la fórmula de densidad despejando "V":
![]()
![]()
Reemplazamos por los datos y calculamos:
![]()
Resultado, el volumen que ocupa esa sustancia es:
V = 44,8 dm³
Respuesta a)
Se puede verificar la densidad aplicando la segunda fórmula con las condiciones dadas (10 °C y 900 mm Hg):
![]()
Reemplazamos por los datos y calculamos:
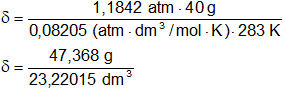
δ = 2,03 g/dm³ ≅ 2 g/dm³
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP01
- | Siguiente ›
Ejemplo de cómo determinar el volumen de un gas