Problema nº 5 de gases ideales, variación de la densidad de un gas - TP02
Enunciado del ejercicio nº 5
Sabiendo que el peso atómico del cloro es de 35,5; calcular su densidad en CNPT y luego a 200 °C y 5 atmósferas.
Desarrollo
Datos:
Masa atómico = 35,5 g
V₁ = 22,4 dm³
p₁ = 1 atm
p₂ = 5 atm
T₁ = 273 K
T₂ = 200 °C = 473 K
Fórmulas:
![]()
![]()
Solución
Calculamos la masa de un mol de cloro:
Mol de Cl₂: 2·35,5 g = 71 g
Calculamos la densidad de un mol en CNPT:
![]()
Reemplazamos por los datos y calculamos:
![]()
Resultado, la densidad del cloro en CNPT es:
δ₁ = 3,15 g/dm³
En el segundo caso la masa se mantiene constante, lo que varía es el volumen.
De la ecuación general de los gases ideales despejamos V₂:
![]()
![]()
Reemplazamos por los datos y calculamos:
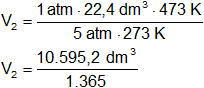
V₂ = 7,7621 dm³
Con este dato y la masa calculamos la densidad a 200 °C y 5 atmósferas:
![]()
Reemplazamos por los datos y calculamos:
![]()
Resultado, la densidad del cloro a 200 °C y 5 atmósferas es:
δ₂ = 9,15 g/dm³
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP02
- | Siguiente ›
Ejemplo de cómo determinar la variación de la densidad de un gas