Problema nº 2 de gases ideales, volumen final de un gas - TP03
Enunciado del ejercicio nº 2
10 litros de hidrógeno están a 0 °C y 5 atmósferas de presión, se calienta el gas a presión constante hasta 20 °C y luego se lo expande a temperatura constante hasta obtener una presión de 2 atmósferas. ¿Cuál será el volumen final del gas?
Desarrollo
Datos:
V₁ = 10 l = 10 dm³
T₁ = 0 °C = 273 K
T₂ = 20 °C = 293 K
p₁ = 5 atm
p₃ = 2 atm
Fórmulas:
![]()
Solución
La primera parte del proceso ocurre a presión constante, la ecuación general de los gases ideales queda:
![]()
Despejamos V₂ de la ecuación:
![]()
Reemplazamos por los datos y calculamos:
![]()
V₂ = 10,7326 dm³
La segunda parte del proceso ocurre a temperatura constante, la ecuación general de los gases ideales queda:
p₂·V₂ = p₃·V₃
Despejamos V₃ de la ecuación:
![]()
Reemplazamos por los datos y calculamos:
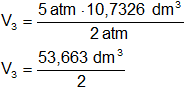
V₃ = 26,8315 dm³
Resultado, el volumen final del gas es:
V₃ = 26,83 dm³
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP03
- | Siguiente ›
Ejemplo, cómo determinar el volumen final de un gas