Problema nº 8 de gases ideales, moles y moléculas de un gas - TP03
Enunciado del ejercicio nº 8
Se tienen 10 litros de hidrógeno a 27 °C y 2 atmósferas de presión, calcular:
a) Número de moles.
b) Número de moléculas.
c) Número de átomos.
Desarrollo
Datos:
V₁ = 10 l
p₁ = 2 atm
T₁ = 27 °C
Fórmulas:
![]()
Solución
Convertimos las unidades:
V₁ = 10 l = 10 dm³
T₁ = 27 °C = 300 K
Aplicamos la ecuación general de los gases ideales para determinar el volumen que ocuparía el hidrógeno en CNPT, despejamos V₂:
![]()
Reemplazamos por los datos y calculamos:
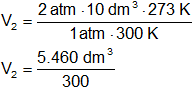
V₂ = 18,2 dm³
a)
Mediante regla de tres simple calculamos los moles de hidrógeno (H₂) en las condiciones dadas:
| 22,4 dm³ de H₂ | ⟶ | 1 mol |
| 18,2 dm³ de H₂ | ⟶ | x |
| x = | 18,2 dm³ de H₂·1 mol de H₂ |
| 22,4 dm³ de H₂ |
Resultado, los moles de hidrógeno son:
x = 0,8125 moles de H₂
b)
Calculamos las moléculas de hidrógeno (H₂) en las condiciones dadas:
| 22,4 dm³ de H₂ | ⟶ | 6,02·10²³ moléculas |
| 18,2 dm³ de H₂ | ⟶ | x |
| x = | 18,2 dm³ de H₂·6,02·10²³ moléculas |
| 22,4 dm³ de H₂ |
Resultado, las moléculas de hidrógeno son:
x = 4,89·10²³ moléculas de H₂
c)
Calculamos los átomos de hidrógeno en las condiciones dadas, su molécula es biatómica:
| 22,4 dm³ de H₂ | ⟶ | 2·6,02·10²³ átomos |
| 18,2 dm³ de H₂ | ⟶ | x |
| x = | 18,2 dm³ de H₂·2·6,02·10²³ átomos |
| 22,4 dm³ de H₂ |
Resultado, los átomos de hidrógeno son:
x = 9,78·10²³ átomos
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP03
- | Siguiente ›
Ejemplo, cómo calcular los moles y moléculas de un gas