Problema nº 9 de gases ideales, volumen y densidad de un gas - TP04
Enunciado del ejercicio nº 9
Se obtienen 55 cm³ de nitrógeno a 22 °C y presión atmosférica de 755 mm Hg, determinar:
a) El volumen normal.
b) La densidad a 20 °C.
Desarrollo
Datos:
V₁ = 55 cm³
p₁ = 755 mm Hg
p₂ = 1 atm
T₁ = 22 °C
T₂ = 0 °C
T₃ = 20 °C
R = 0,08205 atm·dm³/K·mol
Fórmulas:
![]()
p·V·mol = m·R·T
![]()
Solución
Convertimos las unidades:
![]()
p₁ = 0,9934 atm
V₁ = 55 cm³ = 0,055 dm³
T₁ = 22 °C = 295 K
T₂ = 0 °C = 273 K
T₃ = 20 °C = 293 K
a)
Aplicamos la ecuación general de los gases ideales, despejamos V₂:
![]()
Reemplazamos por los datos y calculamos:
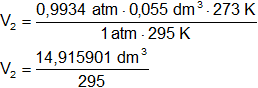
Resultado, el volumen final del gas es:
V₂ = 0,050563 dm³
b)
Calculamos la masa de un mol de nitrógeno gaseoso:
PM N₂: 2·14,0067 g = 28,0134 g
Aplicamos la ecuación estado de los gases ideales para determinar la masa de nitrógeno, despejamos "m":
![]()
Reemplazamos por los datos y calculamos:
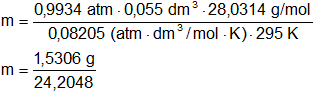
m = 0,0632 g
Aplicamos la ecuación general de los gases ideales para T₃, despejamos V₃:
![]()
Reemplazamos por los datos y calculamos:
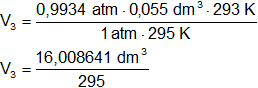
V₃ = 0,054268 dm³
Aplicamos la fórmula de densidad con los datos hallados:
![]()
Resultado, la densidad del nitrógeno a 20 °C es:
δ = 1,165 g/dm³
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP04
- | Siguiente ›
Ejemplo, cómo determinar la densidad de un gas