Problema nº 10 de gases ideales, presión final de un gas - TP04
Enunciado del ejercicio nº 10
Una masa gaseosa a 25 °C ejerce una presión de 12 atmósferas, ¿cuál será el aumento de la presión si es calentada hasta 62 °C manteniendo constante el volumen?
Desarrollo
Datos:
T₁ = 25 °C = 298 K
T₂ = 62 °C = 335 K
p₁ = 12 atm
Fórmulas:
![]()
Solución
El volumen permanece constante, por lo tanto, la ecuación general de los gases ideales queda:
![]()
Despejamos p₂ de la ecuación:
![]()
Reemplazamos por los datos y calculamos:
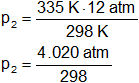
p₂ = 13,48993288 atm
Resultado, la presión que ejerce masa gaseosa es:
p₂ = 13,49 atm
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP04
- | Siguiente ›
Ejemplo, cómo determinar la presión final de un gas