Problema nº 1 de gases ideales, fórmula mínima y molecular - TP13
Enunciado del ejercicio nº 1
El análisis de una sustancia de densidad 8,16 g/dm³ (CNPT) dio la siguiente composición centesimal: Cl = 38,8 % y O = 61,2 %. Calcular la fórmula mínima y molecular.
Desarrollo
Datos:
δsustancia = 8,16 g/dm³
Cl = 38,8 %
O = 61,2 %
Masa atómica Cl = 35,453
Masa atómica O = 15,9994
Vmolar = 22,4 dm³ CNPT
Fórmulas:
![]()
Solución
Conocida la densidad en CNPT podemos calcular la masa de la muestra:
![]()
Despejamos m:
m = δ·V
Reemplazamos por los datos y calculamos:
m = 8,16 g/dm³·22,4 dm³
m = 182,784 g
La masa obtenida equivale al 100 % de la muestra.
Calculamos la masa de cada componente:
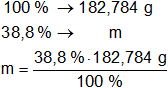
m de Cl = 70,920192 g de Cl
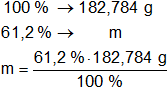
m de O = 111,863808 g de O
Calculamos el número de átomos gramos de cada componente que hay en los 182,784 g de sustancia:
![]()
![]()
![]()
![]()
Respuesta a), la fórmula mínima es: Cl₂O₇.
Respuesta b), En este caso, la fórmula molecular coincide con la fórmula mínima. Se trata del óxido perclórico.
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP13
- | Siguiente ›
Ejemplo, cómo hallar la fórmula mínima y molecular de un gas