Problema nº 3 de gases ideales, fórmula molecular - TP13
Enunciado del ejercicio nº 3
Un hidrocarburo tiene la siguiente composición: C = 82,66 %; H = 17,34 %. La densidad del vapor es 0,2308 g/dm³ a 30 °C y 75 mm Hg. Determinar su peso molecular y su fórmula molecular.
Desarrollo
Datos:
δ = 0,2308 g/dm³
t = 30 °C
p = 75 mm Hg
C = 82,66 %
H = 17,34 %
Masa atómica C = 12,01115
Masa atómica H = 1,00797
R = 0,08205 atm·dm³/K·mol
Fórmulas:
![]()
Solución
Convertimos las unidades de temperatura:
T = 30 °C + 273 °C
T = 303 K
Convertimos las unidades de presión:
![]()
p = 0,098684211 atm
a)
Aplicamos la fórmula dada despejando "PM":
![]()
![]()
Reemplazamos por los datos y calculamos:
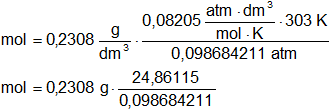
Mol = 58,14459466 g
Resultado a), el peso molecular aproximado del hidrocarburo es 58,145 g.
b)
La masa obtenida equivale al 100 % de la muestra.
Calculamos la masa de cada componente:
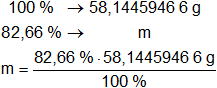
m de C = 48,06137523 g de C
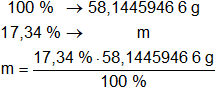
m de H = 10,08321942 g de H
Calculamos el número de átomos gramos de cada componente que hay en los 58,1243 g de sustancia:
![]()
![]()
![]()
![]()
Resultado b), la fórmula molecular es: C₄H₁₀.
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP13
- | Siguiente ›
Ejemplo, cómo hallar la fórmula molecular de un gas