Problema nº 8 de gases ideales, volumen final de un gas - TP13
Enunciado del ejercicio nº 8
¿Qué volumen de oxígeno en CNPT se necesita para la combustión completa de un mol de sulfuro de carbono (CS₂)? ¿Qué volúmenes en CNPT se producen de dióxido de carbono y de dióxido de azufre?
Desarrollo
Datos:
Vmolar = 22,4 dm³ CNPT
Solución
Expresamos la ecuación balanceada de la reacción:
CS₂ + 3·O₂ ⟶ CO₂ + 2·SO₂
Estequiométricamente, la relación de volúmenes es:
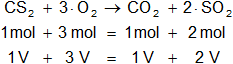
a)
Calculamos el volumen de oxígeno necesario:
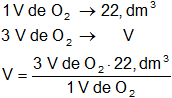
VO₂ = 67,2 dm³ de O₂
Respuesta a): el volumen de oxígeno necesario para la combustión completa de un mol de sulfuro de carbono es 67,2 dm³.
b)
Calculamos el volumen obtenido de dióxido de carbono:
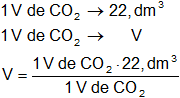
VCO₂ = 22,4 dm³ de CO₂
Respuesta b): el volumen de dióxido de carbono que se formará es 22,4 dm³.
c)
Calculamos el volumen de dióxido de azufre:

VSO₂ = 44,8 dm³ de SO₂
Respuesta c): el volumen de dióxido de azufre que se formará es 44,8 dm³.
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP13
- | Siguiente ›
Ejemplo de cómo determinar el volumen de gas en una reacción