Problema nº 10 de gases ideales, masa y densidad de un gas - TP13
Enunciado del ejercicio nº 10
¿Qué masa de cinc debe disolverse en ácido sulfúrico para obtener 500 cm³ de hidrógeno a 20 °C y 770 mm Hg?
Desarrollo
Datos:
t = 20 °C
p = 770 mm Hg
R = 0,08205 atm·dm³/K·mol
Vmolar = 22,4 dm³ CNPT
Fórmulas:
p·V·mol = m·R·T
Solución
La ecuación estequiométrica balanceada es la siguiente:
H₂SO₄(ac) + Zn(s) ⟶ ZnSO₄(s) + H₂(g)
Calculamos el mol de cada compuesto que interviene en la reacción:
H₂SO₄: 2·1,00797 g + 32,064 g + 4·15,9994 g = 98,07754 g
Zn: 65,37 g = 65,37 g
ZnSO₄: 65,37 g + 32,064 g + 4·15,9994 g = 161,4316 g
H₂: 2·1,00797 g = 2,01594 g
Hallamos las masas de los moles que intervienen en la reacción balanceada, la suma de las masas de ambos miembros debe ser igual:
![]()
Estos cálculos son independientes de las condiciones de temperatura y presión.
Aplicamos la ecuación de estado de los gases en función del peso molecular, despejamos "m":
p·V·mol = m·R·T
![]()
Convertimos las unidades de temperatura:
T = 20 °C + 273 °C
T = 293 K
Convertimos las unidades de presión:
![]()
p = 1,013157895 atm
Convertimos las unidades de volumen:
![]()
VH₂ = 0,5 dm³
Reemplazamos por los datos y calculamos:

mH₂ = 0,042479416 g de H₂
Luego hallamos la masa de cinc necesaria para obtener 0,5 dm³ (500 cm³) de hidrógeno:
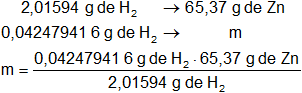
mZn = 1,377461333 g de Zn
Resultado: la masa de cinc que debe disolverse en ácido sulfúrico para obtener 500 cm³ de hidrógeno a 20 °C y 770 mm Hg es 1,38 g.
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP13
- | Siguiente ›
Ejemplo de cómo determinar la masa de un gas en una reacción