Problema nº 2 de gases ideales, peso molecular - TP14
Enunciado del ejercicio nº 2
A 18 °C y 765 mm Hg, 1,29 dm³ de un gas pesa 2,71 g. Calcular el peso molecular aproximado del gas.
Desarrollo
Datos:
Masa = 2,71 g
V₁ = 1,29 dm³
p₁ = 765 mm Hg
p₂ = 1 atm
t₁ = 18 °C
T₂ = 273 K
Vmolar = 22,4 dm³ CNPT
Fórmulas:
![]()
Solución
Para hallar el peso molecular debemos hacer los cálculos en CNPT.
Convertimos las unidades de temperatura:
T₁ = 18 °C + 273 °C
T₁ = 291 K
Convertimos las unidades de presión:
![]()
p₁ = 1,006578947 atm
La masa se mantiene constante, lo que varía es el volumen.
De la ecuación general de los gases ideales despejamos V₂:
![]()
![]()
Reemplazamos por los datos y calculamos:
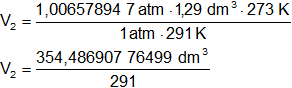
V₂ = 1,218168068 dm³
Mediante regla de tres simple calculamos el peso molecular:
![]()
![]()
Mol = 49,83220426 g
Resultado, el peso molecular aproximado del gas es:
PM = 49,8 g
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP14
- | Siguiente ›
Ejemplo de cómo determinar el peso molecular de un gas