Problema nº 4 de gases ideales, volumen de un gas - TP14
Enunciado del ejercicio nº 4
¿Qué volumen ocuparán 15 g de argón a 90 °C y 735 mm Hg?
Desarrollo
Datos:
m = 15 g
t = 90 °C
p = 735 mm Hg
R = 0,08205 atm·dm³/K·mol
Fórmulas:
p·V·mol = m·R·T
Solución
La molécula de argón es monoatómica, por lo tanto:
PMAr: 39,948 g
Convertimos las unidades:
T = 90 °C + 273 °C
T = 363 K
![]()
p = 0,967105263 atm
Aplicamos la fórmula dada despejando "V":
p·V·mol = m·R·T
![]()
Reemplazamos por los datos y calculamos:
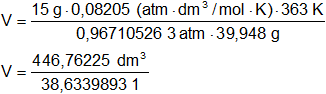
V = 11,56398931 dm³
Resultado, el volumen que ocuparán 15 g de argón a 90 °C y 735 mm Hg es:
V = 11,6 dm³
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP14
- | Siguiente ›
Ejemplo de cómo determinar el volumen ocupado por un gas