Problema nº 4 de la segunda ley de Charles-Gay Lussac de los gases ideales, presión de un gas - TP15
Enunciado del ejercicio nº 4
Un tanque de acero contiene dióxido de carbono a 27 °C y una presión de 12 atmósferas. Determinar la presión interna del gas cuando el tanque se calienta a 100 °C.
Desarrollo
Datos:
p₁ = 12 atm
t₁ = 27 °C
t₂ = 100 °C
Volumen constante.
Fórmulas:
![]()
Solución
Aplicamos la segunda ley de Charles-Gay Lussac de los gases ideales:
![]()
Despejamos p₂:
![]()
Convertimos las unidades de temperatura:
T₁ = 273 °C + 27 °C = 300 K
T₂ = 273 °C + 100 °C = 373 K
Reemplazamos por los datos y calculamos:
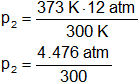
p₂ = 14,92 atm
Resultado, la presión interna del gas a 100 °C es:
p₂ = 14,9 atm
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP15
- | Siguiente ›
Ejemplo de cómo determinar la presión de un gas