Problema nº 5 de gases ideales, presión final de un gas - TP15
Enunciado del ejercicio nº 5
Dados 20 litros de amoníaco a 5 °C y 760 mm Hg. Determinar su volumen a 30 °C y 800 mm Hg.
Desarrollo
Datos:
V₁ = 20 l
p₁ = 760 mm Hg
p₂ = 800 mm Hg
t₁ = 5 °C
t₂ = 30 °C
Fórmulas:
![]()
Solución
Aplicamos la ecuación general de los gases ideales:
![]()
Despejamos V₂:
![]()
Convertimos las unidades de temperatura:
T₁ = 273 °C + 5 °C = 278 K
T₂ = 273 °C + 30 °C = 303 K
V₁ = 20 l = 20 dm³
Reemplazamos por los datos y calculamos:
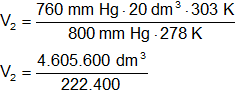
V₂ = 20,70863309 dm³
Resultado, el volumen de la masa de gas a 30 °C y 800 mm Hg es:
V₂ = 20,7 dm³
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP15
- | Siguiente ›
Ejemplo de cómo determinar el volumen de un gas