Problema nº 6 de gases ideales, presión final de un gas - TP15
Enunciado del ejercicio nº 6
¿A cuántas atmósferas de presión debe someterse un litro de gas medido a 1 atm y -20 °C para comprimirlo hasta ½ litro cuando la temperatura es 40 °C?
Desarrollo
Datos:
V₁ = 1 l
V₂ = 0,5 l
p₁ = 1 atm
t₁ = -20 °C
t₂ = 40 °C
Fórmulas:
![]()
Solución
Aplicamos la ecuación general de los gases ideales:
![]()
Despejamos p₂:
![]()
Convertimos las unidades de temperatura:
T₁ = 273 °C - 20 °C = 253 K
T₂ = 273 °C + 40 °C = 313 K
Reemplazamos por los datos y calculamos:
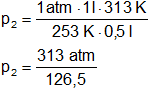
p₂ = 2,4743083 atm
Resultado, la presión que debe someterse el gas es:
p₂ = 2,47 atm
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP15
- | Siguiente ›
Ejemplo de cómo determinar la presión de un gas