Problema nº 8 de gases ideales, masa de un gas - TP15
Enunciado del ejercicio nº 8
Un recipiente contiene 2,55 g de neón en CNPT. ¿Qué masa de neón contendrá a 100 °C y 10 atmósferas?
Desarrollo
Datos:
m₁ = 2,55 g
p₁ = 1 atm
p₂ = 10 atm
t₁ = 0 °C
t₂ = 100 °C
R = 0,082 dm³·atmósfera/mol·K
Fórmulas:
![]()
Solución
El volumen de un mol de cualquier gas en CNPT en 22,4 dm³.
El neón es un gas mono atómico, por tanto, su mol es 20,183 g.
Luego, en las condiciones dadas, el volumen de neón será:
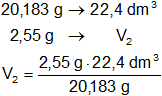
V₂ = 2,830104543 dm³
Aplicamos la ecuación de estado de los gases ideales en función de la masa:
![]()
Convertimos las unidades de temperatura:
T₂ = 273 °C + 100 °C = 373 K
Reemplazamos por los datos y calculamos:

m₂ = 18,67521088 g
Resultado, la masa de neón es:
m₂ = 18,7 g
Se entiende que en este caso el aumento de presión y temperatura se debe a la inyección de gas neón dentro del recipiente.
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP15
- | Siguiente ›
Ejemplo de cómo determinar la masa de un gas