Ley de Richter (gravimétrica o ponderal)
La ley de Richter enuncia que "las masas según las cuales dos elementos se combinan con una masa dada de un tercer elemento son las masas, o un múltiplo o submúltiplo de ellas, según las cuales esos elementos se combinan entre sí".
La expresión matemática para el enunciado anterior es:
![]()
Donde m M y m P son las masas de los elementos M y P.
Siendo r y s números pequeños.
Deducción:
Se tiene un compuesto formado por los elementos M y N y otro compuesto formado por los elementos P y N. Aplicando la ley de Proust:
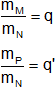
Siendo q y q' las masas de M y de P combinadas con un gramo del elemento N, luego:
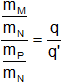
Simplificando:
![]()
La relación de masas entre los elementos M y P es q/q' o un múltiplo de esa cantidad.
Ejemplo:
La composición centesimal de tres compuestos es la siguiente:
Compuesto 1: 88,89 % de O y 11,11 % de H
Compuesto 2: 75 % de C y 25 % de H
Compuesto 3: 27,3 % de C y 72,7 % de O
En los compuestos 1 y 2 el carbono y el oxígeno se combinan con el hidrógeno.
En el compuesto 3 el carbono y el oxígeno se combinan entre sí.
Calculamos para los compuestos 1 y 2 la masa de carbono y oxígeno que se combinan con 1 g de hidrógeno:
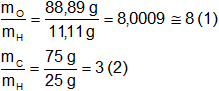
Luego calculamos para el compuesto 3 la relación de masas entre el carbono y el oxígeno:
![]()
Finalmente dividimos los resultados (1) y (2):
![]()
Obtenemos el mismo resultado que en la relación (3).
Bibliografía:
Héctor Fernández Serventi. "Química general e inorgánica". Losada S. A., Buenos Aires.
Robert C. Smoot y Jack Price. "Química, Un curso moderno". Compañía Editorial Continental S. A., México.
Autor: Ricardo Santiago Netto. Argentina
¿Qué dice la ley de las proporciones recíprocas?