Problema nº 1 de ley de conservación de la masa - TP02
Enunciado del ejercicio nº 1
En un sistema químicamente cerrado, se hacen reaccionar 127,2 g de cobre (Cu) con cantidad suficiente de oxígeno (O) y se obtienen 143,2 g de óxido cuproso (Cu₂O):
a) ¿Qué masa de oxígeno se empleó?
b) ¿Qué ley se cumple?
Desarrollo
Datos:
mCu = 127,2 g
mCu2O = 143,2 g
Solución
a)
Por tratarse de un sistema cerrado la masa inicial de la reacción debe ser igual a la masa final de la reacción, es decir, 143,2 g cumpliendo con la ley de conservación de la masa o la primera ley de Lavoisier.
Calculamos la masa de oxígeno:
mO = mCu2O - mCu
mO = 143,2 g - 127,2 g
mO = 16 g
Verificamos, la ecuación estequiométrica es la siguiente:
4·Cu + O₂ ⟶ 2·Cu₂O
Calculamos las masas de los moles que intervienen en la reacción en equilibrio:
4·Cu: 4·63,54 g = 254,16 g
O₂: 2·15,9994 g = 31,998 g
2·Cu₂O: 2·(2·63,54 g + 15,9994 g) = 286,158 g
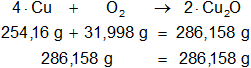
Mediante regla de tres simple calculamos que masa de oxígeno necesaria:
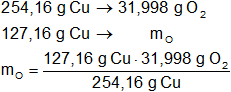
mO = 16,014 g de O₂
b)
Se verifica la ley de conservación de la masa.
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP02
- | Siguiente ›
Ejemplo, cómo verificar la ley de conservación de la masa