Clasificación de las operaciones unitarias
Tienen como objetivo modificar las condiciones de una determinada unidad de masa para conseguir una finalidad. Esta modificación se puede conseguir:
- Modificando su masa o composición
- Modificando su nivel o cantidad de energía
- Modificando las condiciones de movimiento: velocidad
El estado de un cuerpo está absolutamente definido cuando están especificadas la cantidad de materia y composición, cuando conocemos su energía y cuando conocemos las componentes de la velocidad con las que dicho cuerpo está en movimiento.
Estas magnitudes están medidas por la ley de conservación de la materia, energía y cantidad de movimiento. Para transformar una cantidad de materia se producen transformaciones simultáneas de dos o más de estas propiedades.
Estas propiedades, aunque se den simultáneamente, por lo general es una de ellas la que predomina sobre las otras.
De este modo para la clasificación de las operaciones unitarias se atiende a la propiedad que predomina en una transformación. En base a ello la clasificación se hace en dos grandes grupos:
- Operaciones unitarias físicas
- Operaciones unitarias químicas
Operaciones unitarias físicas
- De transferencia de materia
- De transferencia de energía
- De transferencia simultánea de materia y energía
- De transferencia de cantidad de movimiento
- Complementarias
En todas las operaciones unitarias hay en común el concepto de fuerza impulsora. La cantidad de la propiedad transferida por unidad de tiempo y superficie es igual a la fuerza impulsora partido de la resistencia.
Vamos a estudiar la fuerza impulsora para los tres tipos de propiedades.
Materia: La fuerza impulsora es igual a las diferencias de concentraciones, presiones … en el seno del fluido que estemos estudiando.
Energía: La fuerza impulsora se da cuando existe una diferencia de temperaturas en el seno de la masa.
Cantidad de movimiento: La fuerza impulsora es la diferencia de velocidades que existe entre dos zonas del fluido.
Operaciones unitarias químicas
La fuerza impulsora hay que considerarla en relación al aspecto termodinámico (lo que nos indica el avance de la reacción es G < 0). En relación con el aspecto cinético, la velocidad de la reacción química depende de la temperatura y de las concentraciones de los reactivos.
O.U. físicas regidas por transferencia de materia
Están basadas en un fenómeno denominado difusión. Las masas se ponen en movimiento o intentan mezclarse como consecuencia de que existen en el fluido gradientes de concentración. Cuando se colocan dos fases que no se encuentran en equilibrio en relación con un determinado componente lo que ocurre es que dicho componente se transfiere de una a otra intentando alcanzar el equilibrio.
Aprovechando este fenómeno de la difusión se ponen en contacto fases distintas y lo que sucede es que los componentes van a intentar igualarse y se realiza el diseño de aparatos para lograr dicha separación. Esta separación puede tener dos objetivos:
- Separar una sustancia que esté impurificando un fluido
- Separar un compuesto que tenga un valor intrínseco mayor estando por libre
También es posible la separación basándonos en la diferencia de velocidades de difusión a través de una membrana porosa. Es necesario realizarlo en repetidas ocasiones y no siempre es más corriente la separación por transferencia entre fases.
Tipos de O.U. regidas por transferencia de materia:
Destilación
Es la más utilizada en ingeniería química y consiste en separar 2 o más componentes de una mezcla líquida aprovechando sus diferencias en cuanto a la presión de vapor. Supongo una sustancia líquida a una determinada temperatura. Parte de las moléculas de esta sustancia debido a que no todas tienen la misma velocidad, rompen la atracción de las moléculas del líquido y pueden pasar a la fase gaseosa. En la fase gas no todas las moléculas van a tener la misma energía. Aquellas moléculas de las fase gaseosa con menor energía podrán ser atrapadas por el líquido y tendremos una situación de equilibrio entre el líquido y el gas. El manómetro no va a variar e indica la cantidad máxima de moléculas del líquido que podemos tener en la fase de vapor. Existe la misma velocidad en las moléculas de líquido a vapor como de vapor a líquido.
La presión de vapor depende de la temperatura a que trabaje, de la naturaleza de la sustancia. Las sustancias con menor tendencia a pasar a gas son menos volátiles. La cantidad máxima de moléculas en fase gas viene dada por la presión de vapor.
Ejemplo: tenemos un recipiente de 24,5 litros de capacidad a 298 K e introducimos 2 moles de butano líquido. ¿Cuál será la presión de vapor en el interior del tanque? Si bajamos la temperatura a 273 K ¿cuál será la nueva presión?
| pᵥ (butano) | 1.830 torr a 298 K |
| 776 torr a 273 K |
p298: Suponemos 2 moles de gas
p·V = n·R·T ⟶ P·24,5 = 2·0,082.298 ⟶ p = 2 atmósferas = 1.520 torr
p273: p'·V = n·R·T' ⟶ p'·24,5 = 2·0,082·273 ⟶ p' = 1,82 atmósferas = 1.383 torr.
No es correcto porque no puede superar la presión de vapor.
776/760·24,5 = ng·0,082·273 ⟶ ng = 1
1 mol en forma gaseosa y otro en forma líquida.
La mezcla líquida conseguirá separar los compuestos por su volatilidad. La presión de vapor es muy dependiente de la temperatura, a mayor temperatura mayor presión de vapor, hasta que esta se iguale con la presión exterior (1 atmósfera). En este punto el líquido comienza a ebullir. Si la mezcla está constituida por 2 componentes se llama mezcla binaria. Si hay más de 2 componentes se denomina mezcla multicomponente.
Destilación simple:
a) El líquido está contenido en un recipiente denominado calderín. Calentamos el líquido en su parte inferior. Al calentar el líquido este se va evaporando y este vapor es expulsado (la flecha hacia abajo indica que disminuye el volumen del líquido ya que se volatiliza). Discontinua
b) Tenemos una destilación simple contínua ya que constantemente introducimos líquido en el calderín. También se calienta, pero en este caso también sale líquido además de vapor. El líquido que queda en el calderín se mantiene constante (una diferencia con a)
c) Destilación súbita o flash: el alimento se introduce a temperatura elevada, se le da calor externamente y se mantiene a una presión elevada pero sin que hierva, entonces se pasa el líquido regulando la entrada en la columna con una válvula. Dentro de la columna se produce una expansión de los componentes más volátiles, y también una fase líquida más rica en los compuestos más volátiles. En este caso no existe caldera. Estarán en equilibrio los componentes de vaporización y líquido dependiendo de las condiciones de entrada
Regla de las fases
Enunciada por Josiah Willard Gibbs en el siglo XIX dice la relación que existe entre el número de componentes independientes, el número de fases y el de posibilidades de variación de un sistema en equilibrio.
- Componentes: número mínimo de sustancias que hay en el sistema y que son suficientes para definirlo
- Fase: parte homogénea con las mismas propiedades y composición
- Libertades: número de factores que pueden influir en el equilibrio y que pueden ser variables sin que se altere dicho equilibrio (p, T, composición)
F + L = C + 2
Disoluciones ideales
Dos componentes se ponen en contacto y no se produce intercambio de calor (disolución ideal). Un soluto con poca tendencia a pasar a vapor y un disolvente con tendencia a pasar a vapor. Se puede predecir la presión correspondiente a la disolución:
p₁ = p₁·X₁
X₁ = n₁/nT
Rectificación: La destilación con reflujo se llama rectificación. Los apartados d) y e) son rectificaciones pero la primera es contínua y la segunda discontinua. La condensación se realiza por medio de agua fría o serpentín. En el primero se ponen en contacto el vapor ascendente con el líquido descendente. A medida que vamos subiendo los vapores van siendo más ricos en el componente más volátil mientras que en el calderín, a medida que bajamos, el líquido es más rico en el componente menos volátil.
Otra diferencia entre d) y e) es que en la primera la misma cantidad que entra por la alimentación sale por la destilación.
Alimentación = Destilado + Residuo
Por el serpentín del calderín se hace pasar una corriente que se encuentre a mayor temperatura de manera que se de la vaporización. En e) la alimentación se coloca directamente en el calderín y se va consumiendo de manera que desaparece todo en forma de destilado.
La más importante de todas las destilaciones es la rectificación, sobre todo la d).
Destilación extractiva y destilación azeotrópica: se añade un tercer componente que en el caso de la extractiva separa los dos componentes al formar un residuo con uno de los componentes y el otro queda como destilado. En el caso de la destilación azeotrópica, el tercer componente forma un azeótropo con uno de los otros dos, disminuye la presión de vapor de uno de ellos saliendo como residuo o destilado. Estos métodos requieren de una posterior separación.
Destilación por arrastre de vapor: se inyecta vapor de agua recalentado a la mezcla binaria que se quiere separar, sobre todo cuando uno de los componentes se degrada con el vapor. Este vapor reduce la presión parcial de los componentes a destilar con lo que la temperatura de vaporización es menor. El agua no llega a condensar y, por lo tanto, sale de la columna acompañando al destilado y, por lo tanto, se requiere una posterior separación del destilado del agua.
Aparatos empleados en la destilación
• Columnas de destilación: recipientes cilíndricos, verticales, con una entrada lateral por la que se introduce la alimentación. En la parte superior tiene una salida para extraer los vapores que posteriormente se van a condensar dando el destilado. En la parte inferior existe otro orificio por el cual se retira el residuo que va quedando de la destilación. En algunas columnas también existen diversas entradas laterales para introducir la alimentación a distintas alturas. El alimento que se introduce en muchas ocasiones suele estar precalentado para no tener que calentar mucho el calderín. En la columna pretendemos poner en contacto lo más posible el líquido y el vapor
• Columnas de platos (contacto por etapas): los platos retienen una cierta cantidad de líquido en su superficie de manera que se hace borbotear el vapor que procede de la caldera y así se produce un buen intercambio. En el plato no se encuentra en equilibrio el líquido y el vapor. De ese borboteo se produce un vapor más rico en el componente más volátil y el líquido cada vez es más rico en el componente menos volátil. Este proceso se produce repetidas veces. (Figura b) Los platos más corrientes suelen tener un rebosadero en la parte lateral. El paso de vapor tiene lugar según el apartado b), por medio de los borboteadores (de válvula o de campana). La eficacia de estos platos no alcanza el 100% y por tanto se puede medir en una instalación industrial
• Columnas de relleno: es una forma alternativa de poner en contacto el vapor con el líquido. Para ello suele tener una pequeña relación diámetro-altura. Colocamos una serie de superficies con orientación arbitraria. Las características de los sólidos que se colocan en el interior de la columna son:
∘ Peso pequeño
∘ Gran superficie de contacto
∘ No se compacta
∘ Buena resistencia mecánica
∘ Resistente a la corrosión
Aplicaciones de la destilación
- Industria petroquímica
- Recuperación de disolventes
- Fabricación de bebidas alcohólicas
Absorción
Es una operación unitaria regida por transferencias de materia que consiste en poner en contacto un gas con líquido con el objetivo de que en él se disuelva alguno de los componentes del gas.
Desorción
Operación contínua a la absorción y en ella un gas disuelto en un líquido es arrastrado por un gas inerte quedando eliminado del líquido inicial. En algunas ocasiones la desorción también se emplea para determinar la destilación súbita.
La transferencia de materia tiene lugar porque la presión parcial del componente gaseoso en la fase líquida es menor que la presión que tendría una disolución en fase líquida con ese gas. Esto se basa en la ley de Henry que nos indica la máxima solubilidad de un gas en líquido.
Ejemplo: A 20 °C el O₂ se disuelve en agua. K = 2,95·10⁷ torr. En condiciones normales donde p(O₂) = 0,21 atmósferas. ¿Cuántos moles de O₂(g) se disuelven en 1 kg de H₂O?
Desarrollo
Datos:
K = 2,95·10⁷ torr
p(O₂) = 0,21 atmósferas
magua = 1 kg
Fórmulas:
K = p/X
Solución
Ley de Henry: La concentración de un gas disuelto en un líquido es proporcional a la presión parcial de dicho gas: K = p/X. Esta ley solo sirve cuando no hay reacciones químicas, y para disoluciones diluidas.
0,21 atmósferas = 160 torr
n° moles H₂O = 1.000/18 = 55,5
2,95 = 160/Xg ⟶ No₂ = 3·10⁻⁴ moles O₂
Los aparatos empleados en estas técnicas son columnas en las que no se requiere caldera y tampoco hace falta colocar ningún refrigerante. Dos tipos:
- Columnas de relleno
- Columnas de platos
Se diferencian de las anteriores en que se colocan dispositivos para facilitar el contacto entre las fases. Se colocan en la parte superior torres de pulverización. También se hace pasar el líquido a presión por la parte superior. El gas se introduce por la parte inferior y se dice que líquido y gas van a contracorriente. También hay unos absorbedores especiales, los centrífugos, en los que se aplica una energía cinética adicional por rotación al líquido.
Los procesos químicos en los que se aplica la absorción es la eliminación de gases ácidos; secado del cloro (con H₂SO₄).
Extracción
Está basada en la disolución de uno o varios componentes de una mezcla en un disolvente selectivo. La mezcla puede ser líquida o sólida:
- Extracción líquido-líquido: Se requiere que los dos líquidos que se ponen en contacto sean inmiscibles. Representa una solución ventajosa con relación a la destilación porque permite extraer varias sustancias que tengan un grupo funcional parecido. Para no utilizar la destilación con arrastre de vapor se emplea este método
- Extracción sólido-líquido: también llamada lavado, lixiviación, percolación … Si pretendemos un componente no deseado de un sólido se denomina lavado. Lixiviación se emplea cuando se desea extraer un componente valioso. Percolación se emplea para indicar que existe el vertido de un líquido sobre un sólido
El fundamento de la extracción líquido-líquido requiere que los dos líquidos no sean miscibles, por ello la extracción depende del coeficiente de reparto. Cuando un soluto se disuelve en dos líquidos no miscibles en contacto entre si, dicho soluto se distribuirá en cada uno de los líquidos en proporción a la solubilidad en cada uno de ellos.
Utensilios de extracción líquido-líquido
- Columnas de relleno: han de utilizarse en contracorriente. Por arriba alimentación y por abajo disolvente
- Columnas pulsadas: dotadas de movimiento de agitación, es decir, columnas girando alrededor de ellas
- Columnas pulsadas horizontales: suelen tener placas perforadas (fig.7)
- Tanques agitadores: mezcladores combinados con decantadores que se colocan a continuación
Utensilios de extracción sólido-líquido
Tendremos que tener en cuenta si el disolvente es volátil o no lo es y si es necesaria su recuperación. A nivel industrial son muy complicados. A nivel de laboratorio tenemos el extractor Soxhlet (fig.8). Por abajo tengo el disolvente en la caldera C, lo que extraigo es A y la alimentación está constituida por A + B. El disolvente se calienta en la caldera y se condensa el vapor. El líquido C cae sobre el sólido A + B que está dentro de una bolsa de papel. Desde arriba se produce la extracción del componente A del sólido A + B; el nivel va subiendo ya que cada vez tengo más líquido. El líquido sale por el sifón y va a caer por la parte de abajo C + A. Así se separa el componente A del B. Siempre realizaremos la extracción con el disolvente puro (por ello es una extracción contínua y muy rápida) ya que A queda en el calderín.
Aplicaciones de la extracción
La extracción líquido-líquido se utiliza en la industria del petróleo para la extracción del asfalto mediante propano líquido.
La extracción sólido-líquido tiene las siguientes aplicaciones: obtención de aceites y grasas animales y vegetales, obtención de extracto de materia vegetal y animal. Industria minera (lixiviación), obtención de azúcar a partir de la remolacha.
Adsorción
Operación unitaria física regida por la transferencia de materia. Consiste en la eliminación de algún componente de una fase fluida mediante un sólido que lo retiene. El fluido puede ser un líquido o un gas. La adsorción es un fenómeno de superficie. En la superficie del sólido se dan interacciones que hacen que las moléculas del fluido queden retenidas. Si son retenidas mediante un enlace químico fuerte se denomina quimisorción. Si son retenidas mediante una interacción débil se denomina fisisorción. El fenómeno contrario a la adsorción se denomina desorción.
Los sólidos empleados han de tener una gran superficie de adsorción como es el caso del carbón activo, gel de sílice, alúmina activada. Para que por ejemplo se de la adsorción tenemos 1 gramo de carbón activo que presenta una superficie de 1.000 m²
En algunos casos la adsorción se denomina percolación ya que tengo una fase fluida y un sólido, pues este nombre se usa cuando el fluido es un líquido.
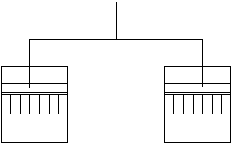
Colocamos el sólido en el interior de la columna formando el lecho fijo, a medida que se hace circular el gas o el líquido a través del sólido se va absorbiendo una determinada sustancia hasta el punto de saturación, en ese punto se dice que se ha llegado a la colmatación. Entonces el sólido ya no puede absorber mayor cantidad del fluido, por ello necesito regenerar este sólido, esto hace que la operación de adsorción se realice en forma semicontinua, es decir, hemos de colocar 2 columnas en paralelo (con sus lechos), y alternativamente hago pasar el fluido primero por una, hasta llegar a la colmatación y luego por la otra.
Mientras la columna está parada se realiza la desorción con agua, disolvente, gas inerte o aire. de esta forma el sólido vuelve a tener capacidad para la adsorción.
Esta forma de actuar es el fundamento de la cromatografía: La mayor o menor tendencia de un sólido a retener un fluido. A nivel industrial se emplea para secar corrientes de gases de su humedad. Se emplea un lecho de gel de sílice. También se emplea en la eliminación de olores, decoloración de líquidos. Para recuperar disolventes contaminantes.
Intercambio iónico
Es una operación unitaria física regida por transferencia de materia que consiste en la sustitución de uno o varios iones de una disolución por otros que inicialmente forman parte de la llamada resina de intercambio iónico.
En toda operación que hay intercambio iónico hay reacción química, una reacción química lo suficientemente rápida que lo que rige la velocidad del proceso es la diferencia de concentraciones entre los componentes (difusión). Las resinas son neutras y formadas por iones; al ponerse en contacto con el fluido se produce un intercambio iónico que produce dos tipos de resinas:
- Resinas catiónicas: el anión es fijo e intercambian el catión
- Resinas aniónicas: el catión es fijo e intercambian el anión
Se emplean en el tratamiento de aguas: para ablandar el agua se sustituyen Mg²⁺, Ca²⁺. La resina en este caso debe ser catiónica con catión Na⁺ que es más soluble que los otros dos lo que facilita su eliminación.
Para regenerar la resina empleamos cloruro sódico y lo hacemos pasar por la disolución.
También se emplea en la desionización o desmineralización de aguas: se colocan 2 columnas (catiónica y aniónica) consecutivas. La catiónica hará el intercambio con protones, la aniónica lo hará con los aniones dando OH⁻. La resina catiónica se regenera con HCl y la aniónica se regenera con NaOH. Al final se añade un tampón para que el agua sea neutra.
O.U. físicas regidas por transferencia de calor
Son solo una parte de aquellas que están regidas por un intercambio de energía.
- Aislamiento térmico
- Calentamiento (o enfriamiento) de fluidos: intercambio de calor sin cambio de fase
- Evaporación, condensación, sublimación (liofilización), solidificación (cristalización): intercambio de calor con cambio de fase. La sublimación y la solidificación se engloban dentro de las O.U.F. regidas por transferencia simultánea de materia y calor
Editor: Ricardo Santiago Netto (Administrador de Fisicanet).
- ‹ Anterior
- |
- Siguiente ›