Problema nº 8 cálculo de densidad de la materia, determinación de masa y el volumen - TP08
Enunciado del ejercicio nº 8
a) Calcular el peso del ácido nítrico puro por cm³ del ácido concentrado con 69,8 % en peso de HNO₃ y ρ = 1,42.
b) Calcular el peso del ácido nítrico puro en 60 cm³ de ácido concentrado.
c) ¿Qué volumen de ácido concentrado contiene 63 g de HNO₃ puro?
Desarrollo
Datos:
ρ = 1,42
CHNO₃ = 69,8 %
Fórmulas:
![]()
![]()
Solución
a)
Aplicamos la fórmula de peso específico relativo:
![]()
Esta fórmula nos dice que:
![]()
O que por cada 1,000 g de agua hay 1,42 g de ácido, no importa la unidad de masa, solo importa que ambas sean iguales.
1,000 kg de agua ≅ 1,000 l de agua.
La concentración del ácido es del 69,8 % en peso, por tanto:
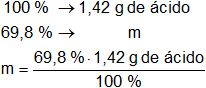
m = 0,99116 g de ácido
Resultado a), la masa de ácido nítrico puro por cm³ es:
m = 0,991 g de HNO₃/cm³ (densidad)
b)
Del paso (a) sabemos que:
δ = 0,991 g/cm³
Aplicamos la fórmula de densidad:
![]()
Despejamos la masa m:
m = V·δ
Reemplazamos por los datos y calculamos:
m = 60 cm³·0,991 g/cm³
m = 59,4696 g
Resultado b), la masa de ácido nítrico puro en 60 cm³ es:
m = 59,5 g de HNO₃
c)
Nuevamente empleamos la densidad hallada en el ítem (a):
δ = 0,991 g/cm³
Aplicamos la fórmula de densidad:
![]()
Despejamos el volumen V:
![]()
Reemplazamos por los valores y calculamos:
![]()
V = 63,56188708 cm³
Resultado c), el volumen de ácido concentrado que contiene 63 g de HNO₃ puro es:
V = 63,6 cm³
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP08
- | Siguiente ›
Ejemplo de cómo determinar la masa