Problema nº 1-a de compuestos orgánicos, composición centesimal de un compuesto - TP01
Enunciado del ejercicio nº 1-a
Calcular la composición centesimal de cada elemento en el siguiente compuesto:
CH₄O
Solución
La masa de cada elemento que interviene es:
1 C = 12 g
4 H = 4·1 g = 4 g
1 O = 16 g
Calculamos el mol del compuesto, este corresponde al 100% de la masa:
CH₄O: 12 g + 4 g + 16 g = 32 g
Aplicamos regla de tres simple y calculamos el porcentaje de cada elemento.
Para el carbono:
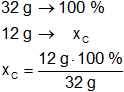
Resultado, el porcentaje de carbono es:
xC = 37,50 %
Para el hidrógeno:

Resultado, el porcentaje de hidrógeno es:
xH = 12,50 %
Para el oxígeno:
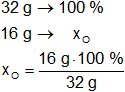
Resultado, el porcentaje de oxígeno es:
xO = 50,00 %
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP01
- | Siguiente ›
Ejemplo, cómo calcular la composición centesimal de un compuesto