Problema nº 2 de compuestos orgánicos, composición centesimal, fórmula empírica de un compuesto - TP01
Enunciado del ejercicio nº 2
Analizando una sustancia compuesta por C, H y O, calentándola en presencia de una corriente oxígeno (se oxida), se ha obtenido 0,3960 g de CO₂ y 0,1620 g de H₂O, habiendo partido de 0,2700 g de muestra. ¿Cuál es la composición centesimal? Determinar la fórmula empírica.
Solución
a) Composición centesimal.
Calculamos el mol de los compuestos hallados:
H₂O: 2·1 g + 16 g = 18 g
CO₂: 12 g + 2·16 g = 44 g
Calculamos la masa de cada elemento los compuestos hallados:
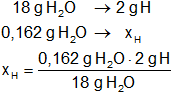
xH = 0,018 g de hidrógeno
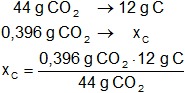
xC = 0,108 g de carbono
Calculamos los porcentajes de carbono e hidrógeno en la muestra:
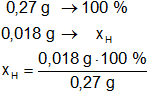
Resultado, el porcentaje de hidrógeno es:
xH = 6,67 %
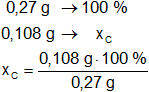
Resultado, el porcentaje de carbono es:
xC = 40,00 %
Por diferencia calculamos el porcentaje de oxígeno:
xO = 100 % - 6,67 % - 40,00 %
Resultado, el porcentaje de oxígeno es:
xO = 53,33 %
b) Fórmula empírica.
La relación más sencilla en átomos-gramo se halla dividiendo el porcentaje de cada elemento por su peso atómico:
![]()
nH = 6,67
![]()
nC = 3,33
![]()
nO = 3,33
Para simplificar y obtener números enteros dividimos todos los valores por el menor de ellos:
![]()
nH = 2
![]()
nC = 1
![]()
nO = 1
Resultado, la fórmula empírica es:
CH₂O
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP01
- | Siguiente ›
Ejemplo, cómo calcular la composición centesimal y la fórmula empírica de un compuesto