Problema nº 4 de compuestos orgánicos, fórmula molecular de un compuesto - TP01
Enunciado del ejercicio nº 4
Un hidrocarburo gaseoso tiene un peso molecular de 30 y contiene 80 % de C y 20 % de H. ¿Cuál es la fórmula molecular?
Solución
Calculamos las masas de carbono e hidrógeno en el hidrocarburo:
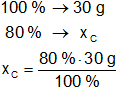
Resultado, la masa de carbono es:
xC = 24 g
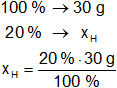
Resultado, la masa de hidrógeno es:
xH = 6 g
Calculamos la fórmula molecular dividiendo las masas halladas por el peso atómico de cada elemento.
![]()
nC = 2 átomos
![]()
nH = 6 átomos
Resultado, la fórmula molecular es:
C₂H₆: etano
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP01
- | Siguiente ›
Ejemplo, cómo calcular la fórmula molecular de un compuesto