Problema nº 6 de compuestos orgánicos, peso molecular y fórmula molecular de un compuesto - TP01
Enunciado del ejercicio nº 6
Siendo la composición centesimal de una sustancia la siguiente:
C: 74,93 %; H: 25,07 %
y su densidad respecto al aire 0,554, determinar su peso molecular y su fórmula.
Desarrollo
Datos:
C = 74,93 %
H = 25,07 %
δᵣ = 0,554
δₐ = 1,293 g/dm³
Fórmulas:
![]()
Solución
a)
La densidad relativa es:
![]()
Despejamos la densidad de la sustancia δₛ:
δₛ = δᵣ·δₐ
Reemplazamos por los datos y calculamos:
δₛ = 0,554·1,293 g/dm³
δₛ = 0,716 g/dm³
Esto nos dice que 1 dm³ de la sustancia pesa 0,716 g.
Calculamos el mol de la sustancia sabiendo que ocupa un volumen de 22,4 dm³:
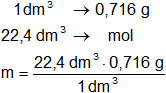
Resultado, el peso molecular es:
mol = 16,046 g
b)
Calculamos las masas de carbono e hidrógeno en la sustancia:
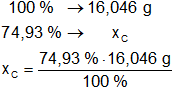
xC = 12,023 g
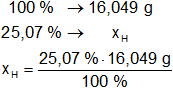
xH = 4,023 g
Calculamos la fórmula molecular dividiendo las masas halladas por el peso atómico de cada elemento.
![]()
nC = 1,002 ≅ 1 átomos
![]()
nH = 4,023 ≅ 4 átomos
Resultado, la fórmula molecular es:
CH₄: metano
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP01
- | Siguiente ›
Ejemplo, cómo calcular la fórmula molecular de un compuesto