Problema nº 7 de compuestos orgánicos, peso molecular y descenso crioscópico de un compuesto - TP01
Enunciado del ejercicio nº 7
Se disuelven 4,6 g de un cierto compuesto orgánico en 1.000 g de agua y el descenso crioscópico observado fue de -0,186 °C. Sabiendo que Kc = -1,86 °C, ¿cuál es el peso molecular del compuesto?
Desarrollo
Datos:
g = 4,6 g de soluto (compuesto orgánico)
G = 1.000 g de agua (disolvente)
d = -0,186 °C
Kc = -1,86 °C (agua).
Ver tabla de constantes molales de los puntos de fusión y ebullición.
Fórmulas:
Descenso crioscópico:
![]()
Solución
Calculamos el peso molecular mediante la fórmula de descenso crioscópico:
![]()
Reemplazamos por los valores y calculamos:
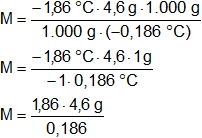
Resultado, el peso molecular del compuesto es:
M = 46 g
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP01
- | Siguiente ›
Ejemplo, cómo calcular el peso molecular de un compuesto