Oxido reducción
¿Qué es una reacción redox?
Una reacción redox es aquella en la que uno de los compuestos se reduce y el otro se oxida, de ahí su nombre.
El reactivo que se oxida está perdiendo electrones que luego cogerá el que se reduce. Y el que se reduce está ganado los electrones que el otro ha soltado. Antiguamente lo que se creía era que el que se oxidaba ganaba oxígeno, en realidad esto era bastante cierto, solo que era incompleto, pues el perder electrones el que se oxida se une con el oxígeno para tener los electrones necesarios.
Ejemplo:
Fe + O₂ ⟶ Fe₂O₃
2·PbO ⟶ 2·Pb + O₂
Agentes oxidantes
El oxidante es aquel de los compuestos que forman parte de una reacción redox que es capaz de oxidar a la otra y que a su vez esta es reducida por la otra.
Ejemplo:
Cu ⟶ Cu²⁺ + 2·e (el cobre se oxida y es capaz de soltar electrones)
Ag⁺ + e ⟶ Ag (la plata se reduce y es capaz de coger electrones)
No se puede producir la reacción contraria porque el cobre es muy mal oxidante y la plata muy mala reductora.
Son buenos oxidantes: O₂ H₂O₂ los permanganatos los dicromatos H₂SO₄
Agentes reductores
El reductor es aquel de los compuestos que forman parte en la reacción redox capaz de reducir al otro y que a su vez esta es oxidada por la otra.
Son buenos reductores: Los no metales y los metales de izquierda a derecha (Cu, Hg, Ag, Au)
Número de oxidación
El número de oxidación es la carga real o formal que tiene un átomo en un compuesto.
Carga real: Es la carga que tiene un átomo en un determinado compuesto
Ejemplo:
NaCl ⟶ Na⁺ + Cl⁻
Carga formal: Es la carga que un átomo podría tener en un compuesto pero que no tiene.
Ejemplo:
H₂O ⟶ 2·H¹⁺ + O⁻
Reglas para el número de oxidación
1) Todos los elementos tienen en su estado natural oxidación 0.
Ejemplo:
Pb°
2) El oxígeno tiene en sus compuestos oxidación -2 excepto en los peróxidos que tiene -1.
Ejemplo:
H₂SO₄²⁻ ⟶ H₂O₂¹⁻
3) El hidrógeno tiene en sus compuestos oxidación +1 excepto en los hidruros metálicos que tiene -1.
Ejemplo:
H₂¹⁺SO₄²⁻
4) Los alcalinos tienen en sus compuestos oxidación +1.
Ejemplo:
H¹⁻K¹⁺
5) Los alcalinotérreos tienen en sus compuestos oxidación +2.
Ejemplo:
K¹⁺Mn²⁺O₄²⁻
6) Los halógenos tienen en sus compuestos con los aluros oxidación -1.
Ejemplo:
Na¹⁺Cl⁻¹
7) La suma de los números de oxidación de todos los átomos de un compuesto es igual a la carga de los compuestos.
Ejemplo:
H₂¹⁺S⁶⁺O₄²⁻
Si algún átomo se oxida su número de oxidación aumenta. Y si se reduce el número de oxidación disminuye.
Ejemplo:
Ca²⁺C⁴⁺O₃²⁻ + 2·H¹⁺Cl⁻¹ ⟶ Ca²⁺Cl₂¹⁻ + H₂¹⁺O²⁻ + C⁴⁺O₂²⁻
Cu° + 2·Ag⁺NO₃⁻ ⟶ 2·Cu⁺NO₃⁻ + 2·Ag°
El cobre se oxida y pierde 2 electrones los cuales toma la plata que se reduce
¿Qué son las pilas?
Pila eléctrica: mecanismo que convierte la energía química en eléctrica. Todas las pilas consisten en un electrolito (que puede ser líquido, sólido o en pasta), un electrodo positivo y un electrodo negativo. El electrolito es un conductor iónico; uno de los electrodos produce electrones y el otro electrodo los recibe. Al conectar los electrodos al aparato que hay que alimentar, llamado carga, se produce una corriente eléctrica.
Las pilas en las que el producto químico no puede volver a su forma original una vez que la energía ha sido convertida (es decir, que las pilas se han descargado), se llaman pilas primarias o voltaicas. Las pilas en las que el producto químico puede ser reconstituido pasando una corriente eléctrica a través de él en dirección opuesta a la operación normal de la pila, se llaman pilas secundarias o acumuladores.
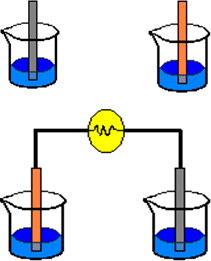 | |
| No pasa nada | Se llena de plata |
La bombilla se enciende, la barra de plata se llena más de plata y la de cobre se hace más delgada.
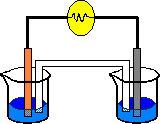
Esto es una pila, que se forma a partir de dos semireacciones separadas. Los electrones que pierde el cobre pasan al otro bote a través del cable. Esta pila se acabaría cuando se acabara el AgNO₃ o el Cu de la barra se gastan. Pero antes de que esto ocurra se para, porque en el agua hay tantas cargas iguales que se repelen, pasa el Cu²⁺ a la disolución de CuNO₃ y al repelerse vuelve a la otra disolución y se junta con los dos electrones sin tener la plata con quién juntarse.
Para evitar esto se puede colocar un tabique poroso para que pasen los NO₃⁻ de un lado y se unan a los Cu²⁺ del otro.
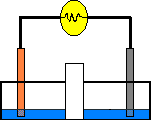
Pero si los poros son lo suficientemente grandes para que pasen los NO₃⁻ tambien pasarían las otras sustancias. Así que se coloca un tubo con una disolución saturada (para que no se salga) de un disolvente electronegativo muy fuerte, por ejemplo de KCl. y se tapa con dos trozos de algodón, de esta forma el circuito eléctrico estará cerrado.
Así al disociarse en K⁺ y Cl⁻ el negativo pasa al lado donde están los Cu²⁺ y los positivos al otro lado.
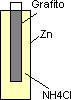
Las pilas normales están hechas de una cubierta de cinc, una barra de grafito en su interior rodeada por un disolución de NH₄Cl que se combina con los dos electrones que pierde el Zn formando amoníaco (NH₃).
Autor: Juan Rodríguez. España.
Editor: Ricardo Santiago Netto (Administrador de Fisicanet).
¿Cuál es la aplicación de la electrolisis? ¿Qué ocurre en el ánodo y el cátodo?