Balance de ecuaciones de óxido-reducción I
Igualación de ecuaciones redox por el método del número de oxidación
Este método se utiliza para reacciones que se realizan por vía seca. También se emplea cuando las ecuaciones se dan en forma molecular.
En este caso las sustancias no se hallan disociadas en iones.
Para lograr el ajuste de ecuaciones, por este método, se debe conocer muy bien el concepto de número de oxidación y de valencia.
Los elementos que no intervienen en la reacción son espectadores y no se incluyen en los pasos (1) y (2), pero sí en la ecuación final completa.
Los pasos son los siguientes:
1) Se determina el cambio del número de oxidación (valencia) del elemento que modifica ese número en el oxidante.
2) Se hace lo mismo con el elemento que modifica la valencia (número de oxidación) en el reductor.
3) Se multiplican, oxidante y reductor, por coeficientes que igualen el cambio del número de oxidación.
4) Se ajusta la ecuación completa para los compuestos no reducidos ni oxidados.
Ejemplo:
Ajustar la ecuación que representa la siguiente reacción por el método del número de oxidación:
S + HNO₃ ⟶ H₂SO₄ + NO
Primero disociamos los compuestos detallando el número de oxidación:
S° + H⁺ + N⁵⁺ + 3·O²⁻ ⟶ 2·H⁺ + S⁶⁺ + 4·O²⁻ + N²⁺ + O²⁻
Observamos que el azufre y el nitrógeno son los elementos que cambian su número de oxidación. Identificamos cual se oxida y cual se reduce:
S° - 6·e ⟶ S⁶⁺ se oxida en 6 unidades
N⁵⁺ + 3·e ⟶ N²⁺ se reduce en 3 unidades
El hidrógeno y el oxígeno son espectadores.
Igualamos los números de oxidación multiplicando por 2 a la segunda ecuación:
S° - 6·e ⟶ S⁶⁺
2·(N⁵⁺ + 3·e ⟶ N²⁺) ⇒ 2·N⁵⁺ + 2·3·e ⟶ 2·N²⁺
2·N⁵⁺ + 6·e ⟶ 2·N²⁺
Sumamos ambas ecuaciones, miembro a miembro:
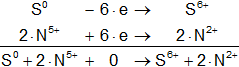
Los coeficientes buscados son: 1, 2, 1 y 2.
La ecuación ajustada es:
S + 2·HNO₃ ⟶ H₂SO₄ + 2·NO
Bibliografía:
Héctor Fernández Serventi. "Química general e inorgánica". Losada S. A., Buenos Aires.
Robert C. Smoot y Jack Price. "Química, Un curso moderno". Compañía Editorial Continental S. A., México.
Autor: Ricardo Santiago Netto. Argentina
Balance de ecuaciones de redox