Celdas voltaicas
Celdas que producen corriente eléctrica por medio de reacciones de oxidación-reducción
En las reacciones redox, las sustancias que intercambian electrones, se hallan en contacto. Es posible lograr el intercambio electrónico sin que las sustancias estén en contacto.
Conceptos previos
Cuando un metal se sumerge en una solución de una de sus sales, existe una tendencia del metal de pasar a la solución en forma de iones y, al mismo tiempo, una presión de los iones del metal de la solución que tienden a depositarse sobre el metal.
Se pueden producir dos casos generales que ejemplificamos a continuación.
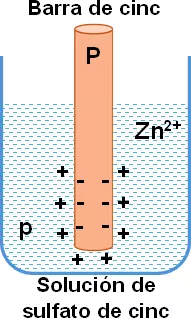
Caso 1: una barra de cinc en una solución de sulfato de cinc (ZnSO₄).
En este caso, la presión electrolítica (P) de la solución del metal es mayor que la presión osmótica (p) de los iones del metal de la solución.
P > p
![]()
Pasan a la solución iones positivos de la barra del metal, el cual queda cargado negativamente porque adquiere los electrones de estos iones. La solución queda cargada positivamente porque cede electrones de sus iones.
Se establece una diferencia de potencial entre el metal y la solución.
Son metales con presiones altas (P), o sea, con gran tendencia a pasar a la solución como iones, por ejemplo, el cinc, el cadmio y el manganeso.
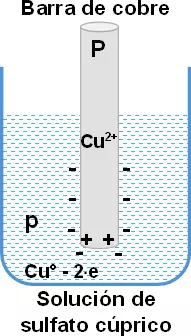
Caso 2: una barra de cobre en una solución de sulfato cúprico (CuSO₄).
Este caso es inverso al anterior. La presión electrolítica de la solución del metal (P) es menor que la presión osmótica de los iones del metal de la solución (p).
P < p
![]()
Se depositan sobre el metal, iones positivos y la solución queda cargada negativamente, estableciéndose, también, una diferencia de potencial entre el metal y la solución.
Son metales con presión baja (P) de solución, por ejemplo, la plata, el oro, el cobre, el mercurio y el platino.
Celda voltaica
Consideremos los casos anteriores combinados, tendremos el esquema básico de una celda voltaica. Si se unen la barra de cobre y la barra de cinc por medio de un alambre, comienza una circulación de electrones de la barra de cinc a la de cobre. Como cada electrón posee carga eléctrica, al circular por el alambre, estos originan en el alambre una corriente eléctrica que se pone de manifiesto por medio de un amperímetro colocado en el alambre.
El esquema del dispositivo es el siguiente:
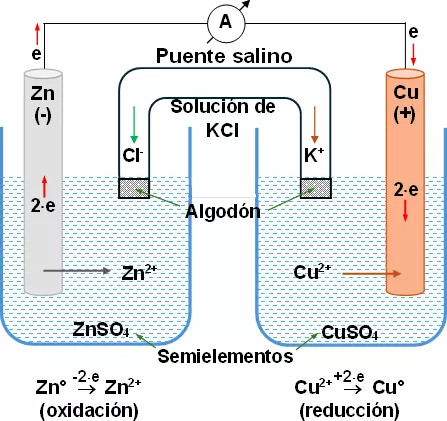
Los dos vasos o hemipilas están unidos por medio de un puente salino de solución de cloruro de potasio (KCl) que asegura el flujo continuo de electrones.
Hemos construido una pila, o sea, una celda productora de corriente eléctrica.
Este tipo de pila galvánica, constituida por las hemipilas: Zn/Zn²⁺ // Cu²⁺/Cu, se llama pila de Daniell.
Una celda voltaica convierte energía química en energía eléctrica.
Funcionamiento
Para que una celda voltaica funcione, es necesario el movimiento libre de los iones entre las hemipilas.
1) La barra de cinc cede a la solución iones cinc y, sobre ella, se depositan electrones.
![]() (proceso de oxidación)
(proceso de oxidación)
2) La solución de sulfato de cobre cede a la barra de cobre, iones cobre.
Tan pronto los iones de cobre se hallan en contacto con la barra de cobre, ganan 2 electrones de ella y se transforman en átomos de cobre que se depositan sobre el metal.
![]() (proceso de reducción)
(proceso de reducción)
Estos electrones provienen de la barra de cinc y llegan al cobre por medio del alambre.
En la hemipila de la derecha, aparece un exceso de iones sulfato (negativos) y en la hemipila de la izquierda, aparece un exceso de cargas positivas producidas por los iones cinc.
El puente salino neutraliza ese exceso, pues cede al vaso de la derecha iones potasio (positivos) y al vaso de la izquierda iones cloro (negativos).
Ambas soluciones permanecen neutras y el flujo electrónico continúa. La circulación de electrones se da de la hemipila de cinc a la de cobre y se mide en el amperímetro.
La hemipila de cinc constituye el polo negativo (ánodo), la hemipila de cobre constituye el polo positivo (cátodo).
En la celda cinc-cobre, el cinc metálico se oxida en el ánodo y el ion cobre se reduce en el cátodo.
Las barras de cinc y cobre se denominan electrodos. Las reacciones se efectúan en electrodos separados, como muestra el esquema.
Bibliografía:
Héctor Fernández Serventi. "Química general e inorgánica". Losada S. A., Buenos Aires.
Robert C. Smoot y Jack Price. "Química, Un curso moderno". Compañía Editorial Continental S. A., México.
Autor: Ricardo Santiago Netto. Argentina
- ‹ Anterior
- |
- Siguiente ›
Las pilas: transformación de energía química en energía eléctrica