Potenciales de oxidación-reducción
Celda patrón
En la pila de Daniell, cambiando el amperímetro por un voltímetro, se medirá un voltaje, cuyo valor depende:
1) De la constitución de las hemipilas.
2) De las concentraciones de las soluciones.
En la pila galvánica (Daniell), si las soluciones son 1 M (molar) y la temperatura de 25 °C, entre los electrodos, aparece una diferencia de potencial de 1,1 V (voltios).
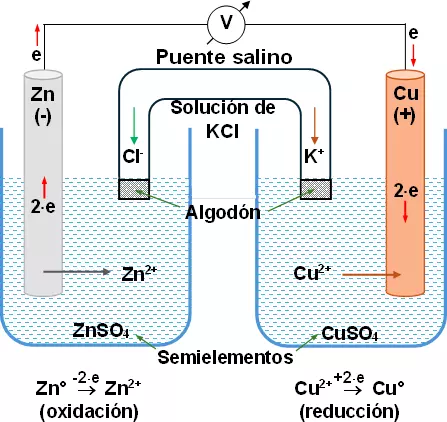
Este potencial o voltaje, mide la tendencia que tienen de verificarse los procesos de oxidación-reducción; por lo tanto, depende del potencial o voltaje del polo negativo y del potencial o voltaje del polo positivo.
Es imposible medir el potencial absoluto de cada electrodo aislado, pues, en el proceso intervienen los dos electrodos.
Por ese motivo, se determina el potencial de oxidación relativo de cada metal. Para ello se emplea un electrodo patrón de comparación, al que se le asigna arbitrariamente el potencial cero.
Este electrodo patrón se denomina hemipila normal de hidrógeno.
Consta de un electrodo constituido por una lámina de platino, recubierta por negro de platino, que le permite saturarse de hidrógeno gaseoso el que se inyecta dentro del tubo a 1 atmósfera de presión.
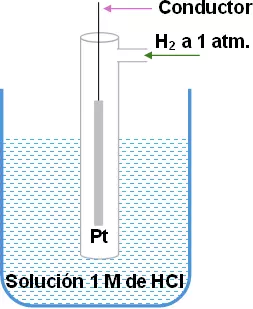
![]()
El electrodo está sumergido en una solución 1 M de HCl.
La temperatura del sistema es de 25 °C.
A este electrodo patrón se lo conecta con otra hemicelda, constituida por una barra del metal, cuyo potencial normal se desea determinar, sumergido en una solución 1 M de una de sus sales.
Ambas hemipilas o hemiceldas se las conecta por un puente salino (solución de KCl).
El voltaje que indica el voltímetro, indica el potencial de oxidación del metal; en este caso el cinc.
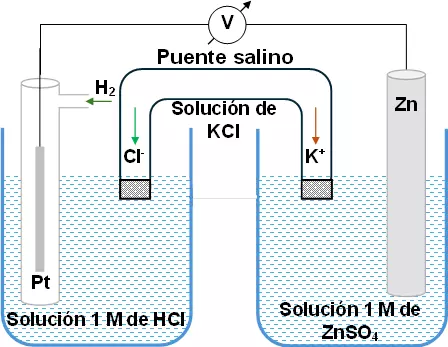
La reacción en el polo negativo es:
![]() (oxidación)
(oxidación)
La reacción en el polo negativo es:
![]() (reducción)
(reducción)
La reacción completa es:
Zn° + 2·H⁺ ⟶ Zn²⁺ + H₂°
La pila anterior se representa en símbolos:
Zn/Zn²⁺ // 2·H⁺/H₂
El voltímetro marca 0,76 voltios.
Este potencial de oxidación del electrodo cinc, mide la capacidad reductora de ese metal, o sea, su tendencia a ceder electrones.
Tabla de potenciales de oxidación normales o estándar
Calculando como se hizo para el cinc, los potenciales de oxidación de los diferentes metales, se construye la tabla de potenciales.
La tabla puede ser de oxidación, donde el voltaje va de positivos a negativos o, una tabla de reducción, donde el voltaje va de negativo a positivos. En ambos casos solo cambia el signo y mantienen el orden.
Los valores corresponden a soluciones 1 M de las sales del metal a 25 °C.
Ver la tabla de potenciales de oxidación-reducción
1) Cualquier elemento de esta serie, reduce a todos los que tiene debajo de él en la tabla.
El litio es el elemento más reductor de la tabla.
2) Esto indica que cada elemento de la tabla desaloja a todos los que se hallan por debajo de él, de sus compuestos.
Así, el hierro (FeII) desaloja al cobre (CuII):
Fe + CuSO₄ ⟶ FeSO₄ + Cu
El cobre (CuII) desplaza a la plata (AgI):
Cu + 2·AgNO₃ ⟶ Cu(NO₃)₂ + 2·Ag
3) Un potencial positivo indica que el elemento es más reductor que el hidrógeno.
4) Por consiguiente, todos los metales situados sobre el hidrógeno lo desalojan de sus ácidos.
2·HCl + Zn ⟶ ZnCl₂ + H₂
2·HCl + Fe ⟶ FeCl₂ + H₂
HCl + Cu ⟶ No reacciona
5) La serie predice el progreso de una reacción:
Zn° + 2·H⁺ ⟶ Zn²⁺ + H₂°
Como el cinc es más reductor que el hidrógeno, pasan iones cinc a la solución (oxidación) y los iones hidrógeno se transforman en moléculas de hidrógeno (reducción).
6) Algunos metales que se hallan por debajo de hidrógeno en la serie reaccionan con ácidos oxidantes, pero no reducen al hidrógeno.
![]()
7) Todos los metales de la serie, hasta el hierro inclusive, reaccionan con el agua, en diversas formas desprendiendo hidrógeno.
Ca + 2·H₂O ⟶ Ca(OH)₂ + H₂
8) Todos los metales, excepto los nobles (mercurio, plata, platino y oro) reaccionan directamente con el oxígeno.
Potencial normal de una pila
El potencial normal es el voltaje que se obtiene en una pila (celda voltaica), cuando la concentración de los iones en cada hemicelda es 1 M o sea, cuando cada uno de los metales se halla sumergido en una solución 1 M de una de sus sales.
La fuerza electromotriz de una pila (f.e.m.), se calcula restando del potencial del electrodo, donde ocurre la oxidación, el valor del potencial de aquel, donde ocurre la reducción:
E = f.e.m. = ΔE⁻ - ΔE⁺
Ejemplo:
a) Celda cinc-hierro.
f.e.m. = 0,76 V - 0,44 V
f.e.m. = 0,32 V
b) Celda cinc-cobre.
f.e.m. = 0,76 V - (-0,34 V)
f.e.m. = 0,76 V + 0,34 V
f.e.m. = 1,1 V
Bibliografía:
Héctor Fernández Serventi. "Química general e inorgánica". Losada S. A., Buenos Aires.
Robert C. Smoot y Jack Price. "Química, Un curso moderno". Compañía Editorial Continental S. A., México.
Autor: Ricardo Santiago Netto. Argentina
- ‹ Anterior
- |
- Siguiente ›
Celda patrón