Problema nº 4 de ecuaciones de óxido reducción, igualar reacciones por el método del número de oxidación - TP03
Enunciado del ejercicio nº 4
Igualar las siguientes reacciones redox por el método del número de oxidación:
a) KClO₃ ⟶ KCl + O₂
b) CaS + HNO₃ ⟶ Ca(NO₃)₂ + NO + S + H₂O
c) HCl + KMnO₄ ⟶ KCl + MnCl₂ + Cl₂ + H₂O
Solución
En todos los casos determinamos el cambio de número de oxidación (valencia) en el oxidante y en el reductor.
a)
KClO₃ ⟶ KCl + O₂
Primero disociamos los compuestos:
K⁺ + Cl⁵⁺ + 3·O²⁻ ⟶ K⁺ + Cl⁻ + O₂°
El potasio no varía.
O²⁻ - 2·e = O₂° (oxidación)
Cl⁵⁺ + 6·e = Cl⁻ (reducción)
Armamos las hemireacciones y equilibramos:
![]()
Multiplicamos la hemirreacción del oxígeno para que el número de electrones tomados o cedidos sea el mismo, luego sumamos.
![]()
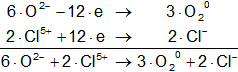
Volvemos a la primera ecuación y la armamos con los nuevos coeficientes:
2·KClO₃ ⟶ 2·KCl + 3·O₂
Observar que los coeficientes hallados se colocaron sólo en los compuestos donde ocurrió oxidación y reducción.
La ecuación queda igualada.
b)
CaS + HNO₃ ⟶ Ca(NO₃)₂ + NO + S + H₂O
Primero disociamos los compuestos:
Ca²⁺ + S²⁻ + H⁺ + N⁵⁺ + 3·O²⁻ ⟶ Ca²⁺ + 2·(N⁵⁺ + 3·O²⁻) + N²⁺ + O²⁻ + S° + 2·H⁺ + O²⁻
Los elementos que varían son:
S²⁻ - 2·e ⟶ S° (oxidación)
N⁵⁺ + 3·e ⟶ N²⁺ (reducción)
Armamos las hemireacciones:
![]()
Multiplicamos las hemirreacciones para que el número de electrones tomados o cedidos sea el mismo, luego sumamos.
![]()
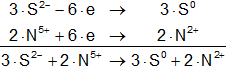
Volvemos a la primera ecuación y la armamos con los nuevos coeficientes:
3·CaS + 2·HNO₃ ⟶ Ca(NO₃)₂ + 2·NO + 3·S + H₂O
Observar que los coeficientes hallados se colocaron sólo en los compuestos donde ocurrió oxidación y reducción.
Terminamos de equilibrar la ecuación:
3·CaS + 8·HNO₃ ⟶ 3·Ca(NO₃)₂ + 2·NO + 3·S + 4·H₂O
La ecuación queda igualada.
c)
HCl + KMnO₄ ⟶ KCl + MnCl₂ + Cl₂ + H₂O
Primero disociamos los compuestos:
H⁺ + Cl⁻ + K⁺ + Mn⁷⁺ + 4·O²⁻ ⟶ K⁺ + Cl⁻ + Mn²⁺ + 2·Cl⁻ + Cl₂° + 2·H⁺ + O²⁻
Los elementos que varían son:
2·Cl⁻ - 2·e ⟶ Cl₂° (oxidación)
Mn⁷⁺ + 5·e ⟶ Mn²⁺ (reducción)
Armamos las hemireacciones:
![]()
Multiplicamos las hemirreacciones para que el número de electrones tomados o cedidos sea el mismo, luego sumamos.
![]()
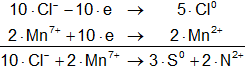
Volvemos a la primera ecuación y la armamos con los nuevos coeficientes:
10·HCl + 2·KMnO₄ ⟶ KCl + 2·MnCl₂ + 5·Cl₂ + H₂O
Observar que los coeficientes hallados se colocaron sólo en los compuestos donde ocurrió oxidación y reducción.
Terminamos de equilibrar la ecuación:
16·HCl + 2·KMnO₄ ⟶ 2·KCl + 2·MnCl₂ + 5·Cl₂ + 8·H₂O
La ecuación queda igualada.
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP03
- | Siguiente ›
Ejemplo, cómo igualar reacciones redox por el método del número de oxidación