Problema nº 7-b de ecuaciones de óxido reducción, igualación dadas en forma iónica - TP03
Enunciado del ejercicio nº 7-b
Balancee la siguiente ecuación:
Cr₂O₇²⁻ + H⁺ + I⁻ ⟶ Cr³⁺ + I₂ + H₂O
Reacción de oxidación del ion yoduro por el ion dicromato con formación de yodo libre.
Solución
La siguiente reacción se realiza en medio acuoso, hay compuestos que están representados en forma iónica e incompleta. Están presentes los elementos que se reducen y los que se oxidan. Nos enfocamos en ellos sin importar los iones o compuestos faltantes.
Cr₂O₇²⁻ + H⁺ + I⁻ ⟶ Cr³⁺ + I₂ + H₂O
Identificamos los elementos e iones que se reducen y los que se oxidan.
El Cr⁷⁺ pasa a Cr³⁺, se reduce, capta 4 electrones.
El I⁻ pasa a I₂°, se oxida, cede 1 electrón.
Armamos las semireacciones paso a paso.
Semirreacción de reducción:
Cr₂O₇²⁻ ⟶ Cr³⁺
Equilibramos los electrones:
Cr₂O₇²⁻ + 8·e ⟶ 2·Cr³⁺
Agregamos el oxgíeno (presente en el agua) y lo equilibramos:
Cr₂O₇²⁻ + 8·e ⟶ 2·Cr³⁺ + 7·H₂O
Compensamos el hidrógeno y lo equilibramos:
Cr₂O₇²⁻ + 8·e + 14·H⁺ ⟶ 2·Cr³⁺ + 7·H₂O (1)
Semirreacción de oxidación:
2·I⁻ ⟶ I₂°
Equilibramos los electrones:
2·I⁻ - 2·e ⟶ I₂° (2)
No hace falta agregar oxígeno o hidrógeno.
Se conserva la clase y la masa de los elementos (Ley de Lavoisier), sus cargas no cuentan.
El balance de la carga está equilibrado en cada semirreacción.
La ecuación completa es (1) y (2):
![]()
Multiplicamos apropiadamente las ecuaciones para poder simplificar los electrones:
![]()
Sumamos ecuación a ecuación:
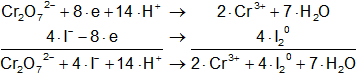
Cr₂O₇²⁻ + 8·I⁻ + 14·H⁺ ⟶ 2·Cr³⁺ + + 4·I₂° + 7·H₂O
La ecuación queda igualada.
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP03
- | Siguiente ›
Ejemplo, cómo igualar ecuaciones redox dadas en forma iónica