Problema nº 1 de ecuaciones de óxido reducción, determinar el número de oxidación - TP05
Enunciado del ejercicio nº 1
Dado que el número de oxidación del hidrógeno es "1+" y el del oxígeno es "2-", calcular el número de oxidación de los demás elementos de los siguientes compuestos:
a) PH₃
b) H₂S
c) H₂SO₄
d) H₂SO₃
e) Al₂O₃
f) HMnO₄
g) MnO₂
Solución
a) PH₃
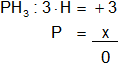
Armamos la ecuación, luego despejamos "x" y calculamos:
3 + x = 0
x = -3
Resultado a): el número de oxidación del "P" es -3
b) H₂S
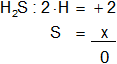
Armamos la ecuación, luego despejamos "x" y calculamos:
2 + x = 0
x = -2
Resultado b): el número de oxidación del "S" es -2
c) H₂SO₄
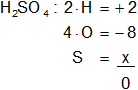
Armamos la ecuación, luego despejamos "x" y calculamos:
2 - 8 + x = 0
x = -2 + 8
x = 6
Resultado c): el número de oxidación del "S" es +6
d) H₂SO₃
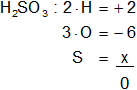
Armamos la ecuación, luego despejamos "x" y calculamos:
2 - 6 + x = 0
x = -2 + 6
x = 4
Resultado d): el número de oxidación del "S" es +4
e) Al₂O₃
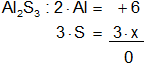
Armamos la ecuación, luego despejamos "x" y calculamos:
-6 + 2·x = 0
2·x = 6
x = 6/2
x = 3
Resultado e): el número de oxidación del "Al" es +3
f) HMnO₄
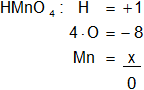
Armamos la ecuación, luego despejamos "x" y calculamos:
-8 + 1 + x = 0
x = 8 - 1
x = 7
Resultado f): el número de oxidación del "Mn" es +7
g) MnO₂
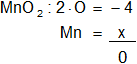
Armamos la ecuación, luego despejamos "x" y calculamos:
-4 + x = 0
x = 4
Resultado g): el número de oxidación del "Mn" es +4
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP05
- | Siguiente ›
Ejemplo, cómo determinar el número de oxidación