Problema nº 5 de estequiometría de las disoluciones, volumen de una disolución - TP01
Enunciado del ejercicio nº 5
¿Qué volumen de solución 0,1 N de KOH se necesitan tomar para tener 2,8 g de dicha base?
Desarrollo
Datos:
m = 2,8 g KOH
C = 0,1 N
Solución
Necesitamos el equivalente gramo del KOH.
Calculamos el mol del hidróxido de potasio:
KOH: 39 g + 16 g + 1 g = 56 g
Tiene 1 oxhidrilo.
El equivalente gramo del hidróxido de potasio es Eg = 56 g, entonces, en una solución 0,1 N hay 0,1 Eg de KOH en un litro de la solución.
Aplicamos regla de tres simple:
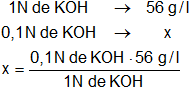
x = 5,6 g/l
Luego:
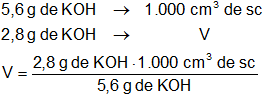
Resultado, el volumen de solución es:
V = 500 cm³
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP01
- | Siguiente ›
Ejemplo, cómo calcular el volumen de una solución