Problema nº 2 de estequiometría de las disoluciones, volumen y normalidad - TP03
Enunciado del ejercicio nº 2
A partir de una solución de ácido nítrico 63 % p/p (δ = 1,2 g/cm³) se desea preparar 1 litro de solución 0,5 N. ¿Qué volumen de ácido se necesita?
Desarrollo
Datos:
C = 63 % p/p
δ = 1,2 g/cm³
N = 0,5 N
V = 1.000 cm³
Fórmulas:
![]()
Solución
Calculamos la masa de ácido nítrico necesaria para una solución 0,5 N:
El equivalente gramo del ácido nítrico es igual a su mol dividido la cantidad de iones hidrógeno que posee en su molécula.
Calculamos el mol del ácido nítrico:
HNO₃: 1 g + 14 g + 3·16 g = 63 g
Tiene 1 hidrógeno:
![]()
El equivalente gramo del ácido nítrico es Eg = 63 g, entonces:
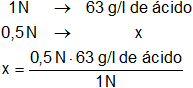
x = 31,5 g de ácido nítrico
La masa de ácido nítrico que hay en la solución inicial es:
63 g de ácido en 100 g de solución (sc).
Como necesitamos 31,5 g de ácido nítrico:
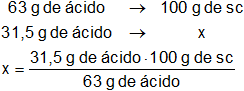
x = 50 g de solución inicial de ácido nítrico
Como pide el volumen:
![]()
![]()
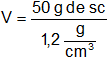
Resultado, el volumen necesario de la solución inicial es:
V = 41,67 cm³
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP03
- | Siguiente ›
Ejemplo, cómo calcular el volumen de una solución