Problema nº 7 de propiedades coligativas, punto de ebullición y punto de solidificación de una disolución - TP06
Enunciado del ejercicio nº 7
Calcular el puto de solidificación y el de ebullición a 1 atmósfera de una disolución (sc) que contiene 30,0 g de azúcar (mol = 342 g) y 150 g de agua.
Desarrollo
Datos:
g = 30,0 g de soluto
G = 150 g de agua (disolvente)
M = 342,0 g
PF* = 0 °C
PE* = 100 °C
Kc = -1,86 °C *
Kₑ = 0,512 °C *
Ver tabla de constantes molales de los puntos de fusión y ebullición.
Fórmulas:
![]()
![]()
PF* = PF + d
PE* = PE + e
Solución
Calculamos el descenso crioscópico:
![]()
Reemplazamos por los valores y calculamos:
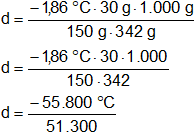
d = -1,087719298 °C
Calculamos el punto de solidificación de la solución:
PF* = PF + d
PF* = 0 °C + (-1,087719298 °C)
PF* = 0 °C - 1,087719298 °C
PF* = -1,087719298 °C
Resultado, el punto de solidificación de la disolución es:
PF* = -1,09 °C
Calculamos el aumento ebulloscópico:
![]()
Reemplazamos por los valores y calculamos:

e = 0,299415205 °C
Calculamos el punto de ebullición de la solución:
PE* = PE + e
PE* = 100 °C + 0,299415205 °C
PE* = 100,299415205 °C
Resultado, el punto de ebullición de la disolución es:
PE* = 100,3 °C
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP06
- | Siguiente ›
Ejemplo, cómo calcular el punto de fusión y el de ebullición de una disolución