Problema nº 9 de propiedades coligativas, presión osmótica de una disolución - TP06
Enunciado del ejercicio nº 9
Una disolución acuosa de urea tiene un punto de solidificación de -0,52 °C. Predecir la presión osmótica de la misma a 37 °C. Suponer que la molaridad y la molalidad son iguales.
Desarrollo
Datos:
t° = 37 °C
PF = 0 °C
PF* = -0,52 °C
R = 0,08205 atm·dm³/K·mol
Kc = -1,86 °C (agua). Ver tabla de constantes molales de los puntos de fusión y ebullición.
Fórmulas:
d = Kc·m
π·V = n·R·T
Solución
Para aplicar la ley de Van't Hoff debemos hallar la concentración de la disolución, empleamos la fórmula del descenso crioscópico:
d = Kc·m
Despejamos la molalidad m:
![]()
En soluciones acuosas diluidas se puede suponer que: molalidad ≅ molaridad.
Convertimos las unidades:
T = 273 + 37
T = 310 K
Aplicamos la ley de Van't Hoff:
π·V = n·R·T
De lo anterior resulta:
m ≅ n
![]()
Reemplazamos n:
![]()
Despejamos π:
![]()
Reemplazamos por los valores y calculamos:
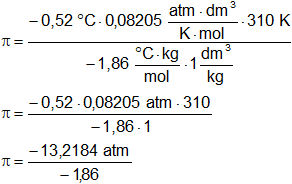
π = 7,106666667 atm
Resultado, la presión osmótica de la disolución es:
π = 7,11 atm
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP06
- | Siguiente ›
Ejemplo, cómo calcular la presión osmótica de una disolución